Struktura, właściwości, synteza i zastosowania cykloheksenu
The cykloheksen jest alkenem lub cykliczną olefiną, której wzór cząsteczkowy to C6H10. Składa się z bezbarwnej cieczy, nierozpuszczalnej w wodzie i mieszalnej z wieloma rozpuszczalnikami organicznymi. Charakteryzuje się łatwopalnością, a w naturze zwykle występuje w smole węglowej..
Cykloheksen jest syntetyzowany przez częściowe uwodornienie benzenu i odwodnienie alkoholu cykloheksanolu; to znaczy bardziej zardzewiała forma. Podobnie jak inne cykloalkeny, ulega reakcjom dodatku elektrofilowego i wolnych rodników; na przykład reakcja halogenowania.
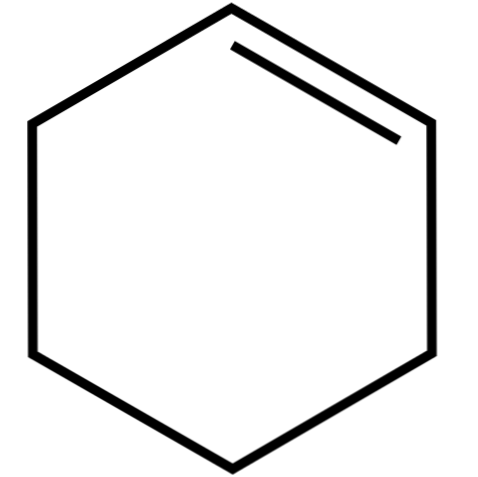
Ten cykliczny alken (górny obraz) tworzy mieszaniny azeotropowe (nierozdzielane przez destylację), z niższymi alkoholami i kwasem octowym. Nie jest bardzo stabilny w długotrwałym przechowywaniu, ponieważ rozkłada się pod wpływem światła słonecznego i promieniowania ultrafioletowego.
Cykloheksen jest stosowany jako rozpuszczalnik, a zatem ma wiele zastosowań, takich jak: stabilizator benzyn wysokooktanowych i do ekstrakcji olejów.
Ale najważniejszą rzeczą jest to, że cykloheksen służy jako półprodukt i surowiec do produkcji wielu przydatnych związków, między innymi: cykloheksanonu, kwasu adypinowego, kwasu maleinowego, cykloheksanu, butadienu, kwasu cykloheksylokarboksylowego itd..
Indeks
- 1 Struktura cykloheksenu
- 1.1 Interakcje międzycząsteczkowe
- 2 Właściwości
- 2.1 Nazwy chemiczne
- 2.2 Masa cząsteczkowa
- 2.3 Wygląd fizyczny
- 2.4 Zapach
- 2.5 Temperatura wrzenia
- 2.6 Temperatura topnienia
- 2.7 Punkt zapłonu
- 2.8 Rozpuszczalność w wodzie
- 2.9 Rozpuszczalność w rozpuszczalnikach organicznych
- 2.10 Gęstość
- 2.11 Gęstość pary
- 2.12 Ciśnienie pary
- 2.13 Samozapłon
- 2.14 Dekompozycja
- 2.15 Lepkość
- 2.16 Ciepło spalania
- 2.17 Ciepło parowania
- 2.18 Napięcie powierzchniowe
- 2.19 Polimeryzacja
- 2,20 Próg zapachu
- 2.21 Współczynnik załamania światła
- 2,22 pH
- 2,23 Stabilność
- 2,24 Reakcje
- 3 Podsumowanie
- 4 zastosowania
- 5 Zagrożenia
- 6 referencji
Struktura cykloheksenu
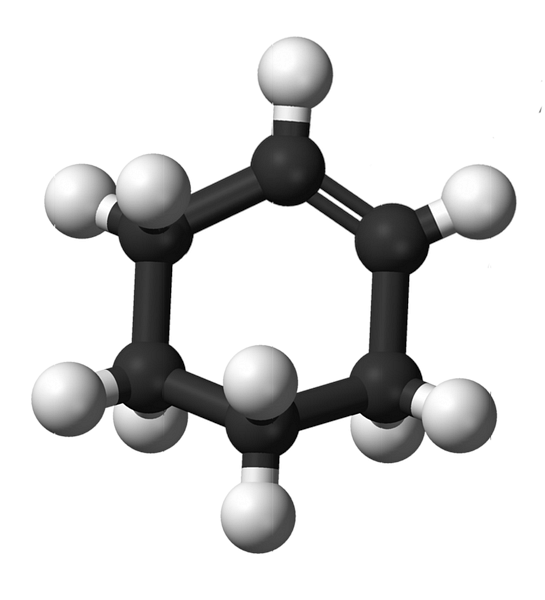
Strukturę cykloheksenu z modelem kul i prętów pokazano na powyższym obrazku. Można zauważyć pierścień sześciowęglowy i wiązanie podwójne, oba nienasycenia związku. Z tej perspektywy wydaje się, że pierścień jest płaski; ale to wcale nie jest.
Na początek węgle podwójnego wiązania mają hybrydyzację sp2, co daje im geometrię płaszczyzny trygonalnej. Dlatego te dwa węgle i te sąsiadujące z nimi znajdują się w tej samej płaszczyźnie; podczas gdy dwa atomy węgla na przeciwległym końcu (do podwójnego wiązania) znajdują się powyżej i poniżej wspomnianej płaszczyzny.
Niższy obraz doskonale ilustruje to, co właśnie zostało wyjaśnione.

Zauważ, że czarny pas składa się z czterech węgli: dwóch wiązań podwójnych i innych sąsiadujących z nimi. Widoczna perspektywa to taka, którą można by uzyskać, gdyby widz umieścił swoje oko dokładnie przed podwójną wiązką. Widać wtedy, że węgiel znajduje się powyżej i poniżej tej płaszczyzny.
Ponieważ cząsteczka cykloheksenu nie jest statyczna, dwa węgle ulegną wymianie: jedna spadnie, a druga wzniesie się ponad płaszczyznę. Można więc oczekiwać, że cząsteczka będzie się zachowywać.
Oddziaływania międzycząsteczkowe
Cykloheksen jest węglowodorem i dlatego jego oddziaływania międzycząsteczkowe opierają się na siłach dyspersyjnych Londynu.
Dzieje się tak, ponieważ cząsteczka jest niepolarna, bez trwałego momentu dipolowego, a jej masa cząsteczkowa jest czynnikiem, który najbardziej przyczynia się do utrzymania jej spójności w cieczy.
Ponadto podwójne wiązanie zwiększa stopień interakcji, ponieważ nie może poruszać się z taką samą elastycznością jak inne węgle, co sprzyja oddziaływaniu między sąsiadującymi cząsteczkami. Z tego powodu cykloheksen ma nieco wyższą temperaturę wrzenia (83 ° C) niż cykloheksan (81 ° C).
Właściwości
Nazwy chemiczne
Cykloheksen, tetrahydrobenzen.
Masa cząsteczkowa
82,146 g / mol.
Wygląd fizyczny
Bezbarwna ciecz.
Zapach
Słodki zapach.
Temperatura wrzenia
83 ºC do 760 mmHg.
Temperatura topnienia
-103,5 ° C.
Punkt zapłonu
-7ºC (zamknięty kubek).
Rozpuszczalność w wodzie
Praktycznie nierozpuszczalny (213 mg / l).
Rozpuszczalność w rozpuszczalnikach organicznych
Miesza się z etanolem, benzenem, czterochlorkiem węgla, eterem naftowym i acetonem. Oczekuje się, że będzie w stanie rozpuszczać związki niepolarne, jak niektóre alotropy węgla.
Gęstość
0,810 g / cm3 w 20ºC.
Gęstość pary
2.8 (w stosunku do powietrza przyjętego jako równego 1).
Ciśnienie pary
89 mmHg w 25 ° C.
Samozapłon
244 ° C.
Rozkład
Rozkłada się w obecności soli uranu pod działaniem światła słonecznego i promieniowania ultrafioletowego.
Lepkość
0,625 mPascal w 25 ° C.
Ciepło spalania
3 751,7 kJ / mol w 25 ° C.
Ciepło parowania
30,46 kJ / mol w 25 ° C.
Napięcie powierzchniowe
26,26 mN / m.
Polimeryzacja
Może polimeryzować w określonych warunkach.
Próg zapachu
0,6 mg / m3.
Współczynnik załamania światła
1,4465 w 20 ° C.
pH
7-8 w 20 ° C.
Stabilność
Cykloheksen nie jest bardzo stabilny podczas długotrwałego przechowywania. Narażenie na światło i powietrze może powodować wytwarzanie nadtlenków. Podobnie jest niekompatybilny z silnymi środkami utleniającymi.
Reakcje
-Cykloalkeny przeżywają głównie reakcje addycyjne, zarówno elektrofilowe, jak i wolne rodniki.
-Reaguje z bromem, tworząc 1,2-dibromocykloheksan.
-Utlenia się szybko w obecności nadmanganianu potasu (KMnO4).
-Jest zdolny do wytwarzania epoksydu (tlenku cykloheksenu) w obecności kwasu peroksybenzoesowego.
Synteza
Cykloheksen jest wytwarzany przez katalizę kwasową cykloheksanolu:
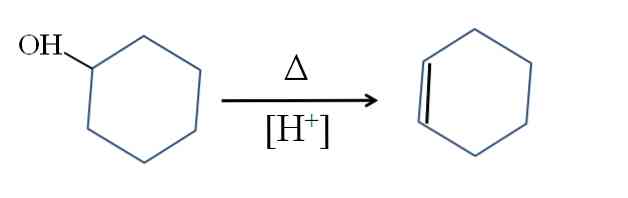
Symbol Δ reprezentuje ciepło niezbędne do promowania wyjścia grupy OH jako cząsteczki wody w środowisku kwaśnym (-OH2+).
Cykloheksen jest również wytwarzany przez częściowe uwodornienie benzenu; to znaczy dwa z podwójnych wiązań dodają cząsteczkę wodoru:
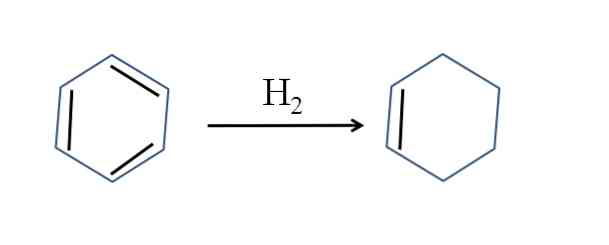
Chociaż reakcja wydaje się prosta, wymaga ona ogromnej presji H2 i katalizatory.
Używa
-Ma użyteczność jako rozpuszczalnik organiczny. Ponadto jest surowcem do produkcji kwasu adypinowego, aldehydu adypinowego, kwasu maleinowego, cykloheksanu i kwasu cykloheksylokarboksylowego.
-Jest on używany do produkcji chlorku cykloheksanu, związku stosowanego jako pośrednik w produkcji produktów farmaceutycznych i dodatków gumowych..
-Cykloheksen jest również stosowany w syntezie cykloheksanonu, surowca do produkcji leków, pestycydów, perfum i barwników.
-Cykloheksen bierze udział w syntezie aminocykloheksanolu, związku, który jest stosowany jako środek powierzchniowo czynny i emulgator..
-Ponadto cykloheksen można stosować do przygotowania w laboratorium butadienu. Ten ostatni związek jest stosowany w produkcji kauczuku syntetycznego, w produkcji opon do samochodów, a także jest stosowany w produkcji tworzyw sztucznych akrylowych.
-Cykloheksen jest surowcem do syntezy lizyny, fenolu, żywicy policykloolefinowej i dodatków kauczukowych.
-Jest stosowany jako stabilizator benzyn wysokooktanowych.
-Zaangażowany w syntezę wodoodpornych powłok, filmów odpornych na pęknięcia i wiążących spoiw do powłok.
Ryzyko
Cykloheksen nie jest bardzo toksycznym związkiem, ale może powodować zaczerwienienie skóry i oczu przez kontakt. Wdychanie może wywołać kaszel i senność. Ponadto spożycie może powodować senność, trudności w oddychaniu i nudności.
Cykloheksen jest słabo wchłaniany w przewodzie pokarmowym, dlatego nie oczekuje się poważnych efektów ogólnoustrojowych z powodu spożycia. Największą komplikacją jest aspiracja przez układ oddechowy, która może wywołać chemiczne zapalenie płuc.
Referencje
- Joseph F. Chiang i Simon Harvey Bauer. (1968). Struktura molekularna cykloheksenu. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cykloheksen: zagrożenia, synteza i struktura. Studiować Źródło: study.com
- Morrison, R. T. i Boyd, R. N. (1987). Chemia organiczna (5ta Edycja.). Od redakcji Addison-Wesley Iberoamericana.
- PubChem. (2019). Cykloheksen. Źródło: pubchem.ncbi.nlm.nih.gov
- Książka chemiczna. (2019). Cykloheksen. Źródło: chemicalbook.com
- Sieć danych toksykologicznych. (2017). Cykloheksen. Toxnet Źródło: toksnet.nlm.nih.gov
- Chemoxy. (s.f.). Wzór strukturalny dla cykloheksenu to. Źródło: chemoxy.com


