Rodzaje ketonów, właściwości, nazewnictwo, zastosowania i przykłady
The ketony są to związki organiczne, które posiadają grupę karbonylową (-CO). Są to proste związki, w których węgiel grupy karbonylowej jest związany z dwoma atomami węgla (i ich łańcuchami podstawnikowymi). Ketony są „proste”, ponieważ nie mają grup reaktywnych, takich jak -OH lub -Cl przyłączone do węgla.
Wreszcie eliminacja ketonów z organizmu ludzkiego jest zwykle związana z niskim poziomem cukru (w przypadkach cukrzycy i / lub skrajnym głodem), co może powodować poważne problemy zdrowotne dla pacjenta.
Indeks
- 1 Ogólna formuła ketonów
- 2 Rodzaje ketonów
- 2.1 W zależności od struktury łańcucha
- 2.2 Zgodnie z symetrią jej rodników
- 2.3 Zgodnie z nasyceniem jej rodników
- 2.4 Diketony
- 3 Właściwości fizyczne i chemiczne ketonów
- 3.1 Temperatura wrzenia
- 3.2 Rozpuszczalność
- 3.3 Kwasowość
- 3.4 Reaktywność
- 4 Nazewnictwo
- 5 Różnica między aldehydami i ketonami
- 6 Przemysłowe i codzienne życie
- 7 Przykłady ketonów
- 7.1 Butanon (C4H8O)
- 7.2 Cykloheksanon (C6H10O)
- 7.3 Testosteron (C19H22O2)
- 7.4 Progesteron (C21H30O2)
- 8 Odniesienia
Ogólna formuła ketonów
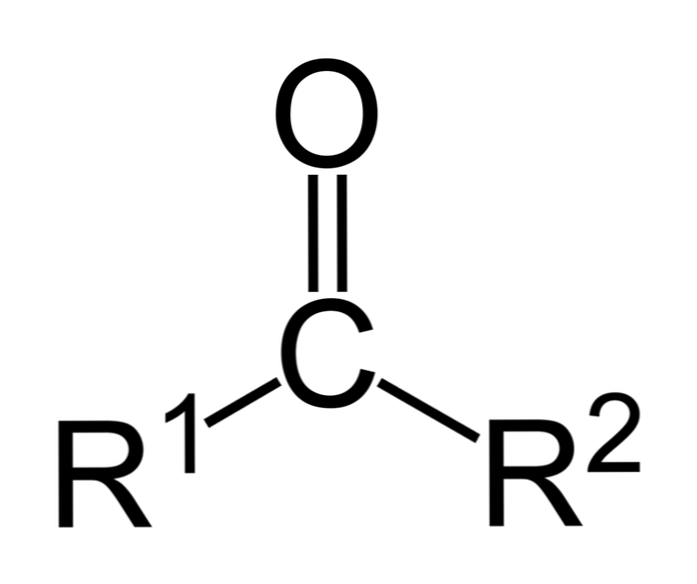
Ketony są związkami karbonylowymi, w których ta grupa jest związana z dwiema grupami węglowodorowymi; mogą to być grupy alkilowe, grupy pierścieniowe benzenu lub oba.
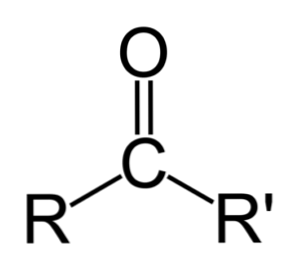
Keton można po prostu przedstawić jako R- (C = O) -R ', gdzie R i R' oznaczają dowolne dwa łańcuchy węglowodorowe (alkany, alkeny, alkiny, cykloalkany, pochodne benzenu i inne). Nie ma ketonów z wodorem przyłączonym do grupy karbonylowej.
Istnieje wiele różnych metod wytwarzania ketonów w środowisku przemysłowym i laboratoryjnym; Ponadto ważne jest, aby pamiętać, że ketony mogą być syntetyzowane przez różne organizmy, w tym ludzi.
W przemyśle najbardziej powszechna metoda syntezy ketonów polega na utlenianiu węglowodorów, zwykle przy użyciu powietrza. Na małą skalę ketony zwykle wytwarza się przez utlenianie drugorzędowych alkoholi, które dają jako produkty keton i wodę.
Poza tymi najpopularniejszymi metodami, ketony mogą być syntetyzowane przez alkeny, alkiny, sole związków azotu, estry i wiele innych związków, co czyni je łatwymi do uzyskania.
Rodzaje ketonów
Istnieje kilka klasyfikacji ketonów, zależnych głównie od podstawników w ich łańcuchach R. Poniżej przedstawiono najczęściej stosowane klasyfikacje tych substancji:
Zgodnie ze strukturą twojego łańcucha
W tym przypadku keton jest klasyfikowany według struktury jego łańcucha: ketony alifatyczne to te, które mają dwa rodniki R i R ', które mają postać rodników alkilowych (alkany, alkeny, alkiny i cykloalkany).
Ze swej strony związki aromatyczne to takie, które tworzą pochodne benzenu, a jednocześnie są ketonami. Na koniec, mieszane ketony to te, które mają rodnik alkilowy R i rodnik arylowy R ', lub odwrotnie.
Zgodnie z symetrią jej radykałów
W tym przypadku bada się podstawniki rodników R i R 'grupy karbonylowej; gdy są one równe (identyczne), keton nazywa się symetryczny; ale kiedy są różne (jak większość ketonów), nazywa się to asymetrycznym.
Zgodnie z nasyceniem jej rodników
Ketony można również klasyfikować według nasycenia ich łańcuchów węglowych; Jeśli są w postaci alkanów, keton nazywany jest nasyconym ketonem. W przeciwieństwie do tego, jeśli łańcuchy występują jako alkeny lub alkiny, keton jest nazywany nienasyconym ketonem.
Dicetony
Jest to oddzielna klasa ketonu, ponieważ łańcuchy tego ketonu mają w swojej strukturze dwie grupy karbonylowe. Niektóre z tych ketonów mają unikalne właściwości, takie jak dłuższa długość wiązania między atomami węgla.
Na przykład diketony pochodzące z cykloheksanu są znane jako chinony, które są tylko dwoma: orto-benzochinonem i para-benzochinonem.
Właściwości fizyczne i chemiczne ketonów
Ketony, podobnie jak większość aldehydów, są cząsteczkami ciekłymi i mają szereg właściwości fizycznych i chemicznych, które różnią się w zależności od długości ich łańcuchów. Jego właściwości są opisane poniżej:
Temperatura wrzenia
Ketony są bardzo lotne, wysoce polarne i nie mogą oddawać wodorów dla wiązań wodorowych (nie posiadają atomów wodoru przyłączonych do swojej grupy karbonylowej), więc mają wyższe temperatury wrzenia niż alkeny i etery, ale niższe niż te alkohole o tej samej masie cząsteczkowej.
Temperatura wrzenia ketonu wzrasta wraz ze wzrostem wielkości cząsteczki. Wynika to z interwencji sił van der Waalsa i sił dipolowo-dipolowych, które wymagają większej ilości energii, aby oddzielić atomy i elektrony przyciągane do cząsteczki..
Rozpuszczalność
Rozpuszczalność ketonów ma silny wpływ częściowo na zdolność tych cząsteczek do przyjmowania wodorów w ich atomie tlenu, a tym samym tworzenia wiązania wodorowego z wodą. Ponadto powstają atrakcyjne, rozproszone i dipolowo-dipolowe siły między ketonami i wodą, które zwiększają ich rozpuszczalny efekt.
Ketony tracą zdolność rozpuszczania się, im większa jest ich cząsteczka, ponieważ zaczynają wymagać więcej energii do rozpuszczenia w wodzie. Są również rozpuszczalne w związkach organicznych.
Kwasowość
Dzięki swojej grupie karbonylowej ketony mają charakter kwaśny; dzieje się tak z powodu zdolności stabilizacji rezonansowej tej grupy funkcjonalnej, która może przenosić protony ze swojego podwójnego wiązania, tworząc bazę sprzężoną zwaną enolem.
Reaktywność
Ketony są częścią dużej liczby reakcji organicznych; dzieje się tak ze względu na podatność węgla karbonylowego na dodatek nukleofilowy, oprócz polarności tego.
Jak stwierdzono powyżej, wysoka reaktywność ketonów czyni je uznanym produktem pośrednim, który służy jako podstawa do syntezy innych związków.
Nomenklatura
Ketony są nazywane zgodnie z priorytetem lub znaczeniem grupy karbonylowej w całej cząsteczce, więc gdy masz cząsteczkę zarządzaną przez grupę karbonylową, keton jest nazywany przez dodanie przyrostka „-on” do nazwy węglowodoru.
Najdłuższy łańcuch z grupą karbonylową jest traktowany jako łańcuch główny, a następnie nazwa cząsteczki. Jeśli grupa karbonylowa nie ma pierwszeństwa przed innymi grupami funkcyjnymi cząsteczki, wówczas jest identyfikowana z „-oxo”.
W przypadku bardziej skomplikowanych ketonów, położenie grupy funkcyjnej można zidentyfikować za pomocą liczby, aw przypadku diketonów (ketonów z dwoma identycznymi podstawnikami R i R '), nazwa cząsteczki z przyrostkiem „-dione”..
Wreszcie, słowo „keton” można również stosować po zidentyfikowaniu łańcuchów rodników przyłączonych do karbonylowej grupy funkcyjnej.
Różnica między aldehydami i ketonami
Największą różnicą między aldehydami a ketonami jest obecność atomu wodoru przyłączonego do grupy karbonylowej w aldehydach.
Atom ten ma ważny wpływ, jeśli chodzi o udział cząsteczki w reakcji utleniania: aldehyd utworzy kwas karboksylowy lub sól kwasu karboksylowego, w zależności od tego, czy utlenianie zachodzi w warunkach kwasowych czy zasadowych.
W przeciwieństwie do tego, keton nie ma tego wodoru, więc minimalne kroki niezbędne do utleniania nie występują.
Istnieją metody utleniania ketonu (z czynnikami utleniającymi o wiele mocniejszymi niż zwykle stosowane), ale te rozbijają cząsteczkę ketonu, oddzielając ją najpierw na dwie lub więcej części.
Wykorzystuje życie przemysłowe i codzienne
W przemyśle ketony często obserwuje się w perfumach i farbach, przyjmując role stabilizatorów i konserwantów, które zapobiegają degradacji innych składników mieszaniny; mają one również szerokie spektrum jako rozpuszczalniki w tych gałęziach przemysłu, które wytwarzają materiały wybuchowe, farby i tekstylia, oprócz środków farmaceutycznych.
Aceton (najmniejszy i najprostszy keton) jest rozpuszczalnikiem rozpoznawanym na całym świecie i jest stosowany jako zmywacz do farb i rozcieńczalnik.
W naturze ketony mogą występować jako cukry, zwane ketozami. Ketozy są monosacharydami, które zawierają jeden keton na cząsteczkę. Najbardziej znaną ketozą jest fruktoza, cukier występujący w owocach i miodzie.
Biosynteza kwasów tłuszczowych zachodząca w cytoplazmie komórek zwierzęcych zachodzi również poprzez działanie ketonów. Na koniec, jak wspomniano powyżej, może wystąpić podwyższenie poziomu ketonów we krwi po na czczo lub w przypadkach cukrzycy.
Przykłady ketonów
Butanon (C4H8O)
Znana również jako MEK (lub MEC), ciecz ta jest wytwarzana na dużą skalę w przemyśle i jest stosowana jako rozpuszczalnik.
Cykloheksanon (C6H10O)
Produkowany na masową skalę keton ten jest stosowany jako prekursor syntetycznego materiału nylonowego.
Testosteron (C19H22O2)
Jest głównym hormonem płci męskiej i sterydem anabolicznym, występującym u większości kręgowców.
Progesteron (C21H30O2)
Endogenny steroid i hormon płciowy zaangażowany w cykl menstruacyjny, ciążę i embriogenezę u ludzi i innych gatunków.
Referencje
- Wikipedia. (s.f.). Keton Źródło z en.wikipedia.org
- Britannica, E. (s.f.). Keton Źródło: britannica.com
- University, M. S. (s.f.). Aldehydy i ketony. Źródło: chemistry.msu.edu
- ChemGuide. (s.f.). Przedstawiamy aldehydy i ketony. Pobrane z chemguide.co.uk
- Calgary, U. O. (s.f.). Ketony. Źródło: chem.ucalgary.ca


