Fundacja Ziehl-Neelsen Stain Foundation, Reagents and Technique
The Plama Ziehl-Neelsen w technice barwienia w celu identyfikacji mikroorganizmów odpornych na alkohol (AAR). Nazwa tej procedury mikrobiologicznej odnosi się do jej autorów: bakteriologa Franza Ziehla i patologa Friedricha Neelsena.
Ta technika jest rodzajem zróżnicowanego zabarwienia, co oznacza użycie różnych barwników w celu stworzenia kontrastu między strukturami, które chcesz obserwować, różnicować i później identyfikować. Barwienie Ziehla-Neelsena stosuje się do identyfikacji niektórych rodzajów mikroorganizmów.
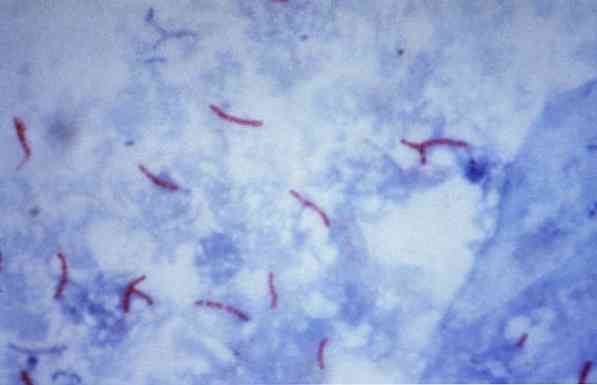
Niektóre z tych mikroorganizmów są prątkami (na przykład, Mycobacterium tuberculosis), nocardias (na przykład, Nocardia sp.) i niektóre jednokomórkowe pasożyty (na przykład, Cryptosporidium parvum). Wiele bakterii można sklasyfikować za pomocą powszechnej techniki zwanej barwieniem metodą Grama.
Jednak niektóre grupy bakterii wymagają innych metod ich identyfikacji. Techniki takie jak barwienie Ziehlem-Neelsenem wymagają kombinacji barwników z ciepłem, aby przymocować pierwsze do ściany komórkowej.
Następnie następuje proces odbarwiania, który pozwala na uzyskanie dwóch wyników: odporności lub wrażliwości na przebarwienia przez kwasy i alkohole.
Indeks
- 1 Fundacja
- 1.1 Barwienie wtórne
- 2 Odczynniki
- 2.1 Pierwotne zabarwienie
- 2.2 Roztwór odbarwiający
- 2.3 Barwienie wtórne (anty-barwnik)
- 3 Technika
- 3.1 Procedura barwienia szybko kwasowego
- 4 odniesienia
Fundacja
Podstawą tej techniki barwienia są właściwości ścian komórkowych tych mikroorganizmów. Ściana jest utworzona przez rodzaj kwasów tłuszczowych zwanych kwasami mikolowymi; Charakteryzują się one bardzo długimi łańcuchami.
Gdy kwasy tłuszczowe mają bardzo długie struktury, mogą łatwiej zatrzymywać barwniki. Niektóre rodzaje bakterii są bardzo trudne do wybarwienia metodą barwienia metodą Grama, ze względu na wysoką zawartość kwasu mikolowego w ścianie komórkowej.
W barwieniu Ziehla-Neelsena stosuje się związek fenolowy Carbol Fuchsin, podstawowy barwnik. Ma to zdolność do interakcji z kwasami tłuszczowymi ściany komórkowej, która jest woskową teksturą w temperaturze pokojowej.
Barwienie fuchsyną Carbolu poprawia się w obecności ciepła, ponieważ wosk topi się, a cząsteczki barwnika szybciej przemieszczają się do ściany komórkowej.
Stosowany później kwas służy do odbarwiania komórek, które nie były barwione, ponieważ ich ściana nie była wystarczająco związana z barwnikiem; dlatego siła odbarwiającego kwasu jest zdolna do usuwania barwnika kwasowego. Komórki odporne na to odbarwienie nazywane są kwasoodpornymi.
Kolorystyka wtórna
Po przebarwieniu próbki kontrastuje to z innym barwnikiem zwanym barwnikiem wtórnym. Zazwyczaj stosuje się błękit metylenowy lub zieleń malachitową.
Drugorzędny barwnik plami materiał tła, aw konsekwencji tworzy kontrast ze strukturami, które zostały zabarwione w pierwszym etapie. Tylko przebarwione komórki wchłaniają drugi barwnik (anty-plama) i przyjmują kolor, podczas gdy komórki kwasoodporne zachowują czerwony kolor.
Ta procedura jest często używana do identyfikacji Mycobacterium tuberculosis i Mycobacterium leprae, które nazywane są prątkami kwasoodpornymi.
Odczynniki
Kolorystyka pierwotna
Używa się 0,3% karboksyny (filtrowanej). Barwnik ten wytwarza się z mieszaniny alkoholi: fenolu w etanolu (90%) lub metanolu (95%) iw tej mieszaninie rozpuszcza się 3 gramy zasadowej fuksyny.
Roztwór odbarwiający
W tym kroku można użyć roztworów 3% kwasu alkoholowego lub 25% kwasu siarkowego.
Barwienie wtórne (anty-barwnik)
Barwnik najczęściej stosowany do wykonywania kontrastu w próbkach wynosi zazwyczaj 0,3% błękitu metylenowego. Jednak można również użyć innych, takich jak 0,5% malachitowej zieleni.
Technika
Procedura barwienia szybko kwasowego
Przygotuj rozmaz bakteryjny
Ten preparat jest przygotowywany na czystym i suchym szkiełku, zgodnie ze środkami ostrożności dotyczącymi sterylności.
Suszenie rozmazu
Pozostaw rozmaz do wyschnięcia w temperaturze pokojowej.
Podgrzać próbkę
Próbka musi zostać podgrzana poprzez zastosowanie ognia na slajdzie poniżej. Fiksacja alkoholem może być przeprowadzona, gdy rozmaz nie został przygotowany plwociną (traktowaną podchlorynem sodu w celu jego wybielenia) i jeśli nie zostanie natychmiast zabarwiony..
M. tuberculosis Jest eliminowany za pomocą wybielacza i podczas procesu barwienia. Thermofixing nieleczonej plwociny nie zabije M. tuberculosis, mając na uwadze, że fiksacja alkoholem jest bakteriobójcza.
Zakryj plamę
Bejca jest pokryta roztworem fuksyny karbolu (podstawowa bejca podstawowa).
Podgrzej plamę
Robi się to przez 5 minut. Należy zauważyć uwolnienie pary (około 60 ° C). Ważne jest, aby nie przegrzewać i unikać spalania próbki.
Jeśli chodzi o podgrzewanie plamy, należy zachować szczególną ostrożność podczas podgrzewania karafki fuksyny, zwłaszcza jeśli barwienie przeprowadza się na tacy lub innym pojemniku, w którym z poprzedniej plamy zebrano wysoce łatwopalne chemikalia.
Pod szkiełkami należy nakładać tylko niewielki płomień za pomocą zapalonego wacika uprzednio zwilżonego kilkoma kroplami kwaśnego alkoholu, metanolu lub 70% etanolu. Unikaj używania dużego wacika nasączonego etanolem, ponieważ jest to zagrożenie pożarowe.
Umyj plamę
To mycie należy wykonywać czystą wodą. Jeśli woda z kranu nie jest czysta, wymyj rozmaz, najlepiej wodą filtrowaną lub destylowaną.
Zakryj rozmaz kwaśnym alkoholem
Ten kwaśny alkohol powinien wynosić 3%. Pokrycie przeprowadza się przez 5 minut lub do momentu, gdy rozmaz jest wystarczająco odbarwiony, to znaczy blado różowawy.
Należy wziąć pod uwagę, że alkohol kwaśny jest łatwopalny; dlatego należy go używać bardzo ostrożnie. Unikaj przebywania w pobliżu źródeł zapłonu.
Umyj plamę
Mycie powinno odbywać się czystą, destylowaną wodą.
Przykryj rozmaz barwnikiem
Może to być barwnik zielony malachit (0,5%) lub błękit metylenowy (0,3%) przez 1 lub 2 minuty, przy użyciu najdłuższego czasu, jeśli rozmaz jest cienki.
Umyj plamę
Czysta woda musi być ponownie użyta (destylowana).
Opróżnij
Tył prowadnicy powinien być oczyszczony, a plamę należy umieścić na półce drenażowej, tak aby została wysuszona na powietrzu (nie używaj chłonnego papieru do suszenia).
Zbadaj rozmaz w mikroskopie
Należy użyć obiektywu 100X i oleju immersyjnego. Systematycznie skanuj rozmaz i zapisz odpowiednie obserwacje.
Zinterpretuj wyniki
Teoretycznie mikroorganizmy zabarwione na czerwono są uważane za kwasooporne (AAR +).
Przeciwnie, jeśli mikroorganizmy są zabarwione na niebiesko lub zielono, w zależności od barwnika użytego jako przeciw-barwnik, są one uważane za ujemny kwas odporny na alkohol (AAR-).
Referencje
- Apurba, S. & Sandhya, B. (2016). Podstawy praktycznej mikrobiologii (Pierwsze wydanie). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Mikrobiologia z chorobami według Body System (4 ed.). Pearson Education, Inc.
- Heritage, J., Evans, E. i Killington, A. (1996). Mikrobiologia wprowadzająca (Pierwsze wydanie). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. i Morton, V. (2006). Podręcznik laboratoryjny i skoroszyt w mikrobiologii: zastosowania do opieki nad pacjentem (11 ed.). McGraw-Hill Education.
- Vasanthakumari, R. (2007). Podręcznik mikrobiologii (Pierwsze wydanie). B.I. Publikacje PVT.


