Barwienie Giemsa, materiały, technika i zastosowania
The Plama Giemsa to rodzaj barwienia próbek klinicznych, oparty na mieszaninie barwników kwasowych i zasadowych. Inspiracją dla jego powstania były prace Romanowskiego, w których Gustav Giemsa, chemik i bakteriolog pochodzący z Niemiec, udoskonalił go, dodając glicerol w celu stabilizacji związków.
Zmiany wprowadzone do oryginalnej techniki Romanowskiego pozwoliły znacznie poprawić obserwacje mikroskopowe, dlatego technika została ochrzczona nazwą Giemsa.
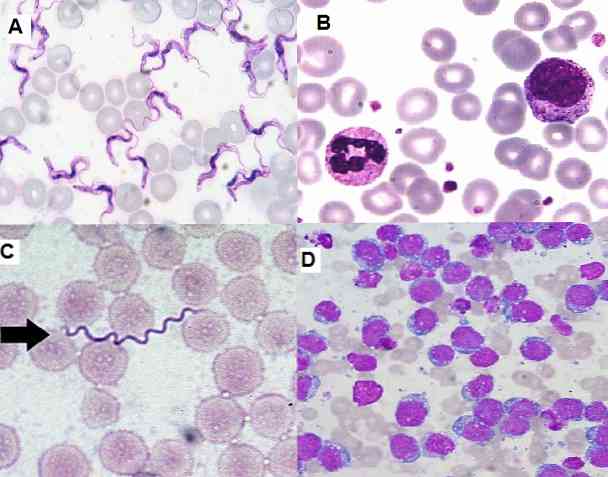
Ponieważ jest to prosta technika do wykonania, wysoce funkcjonalna i ekonomiczna, jest obecnie szeroko stosowana w laboratorium klinicznym do rozmazów hematologicznych, próbek szpiku kostnego i skrawków tkanek..
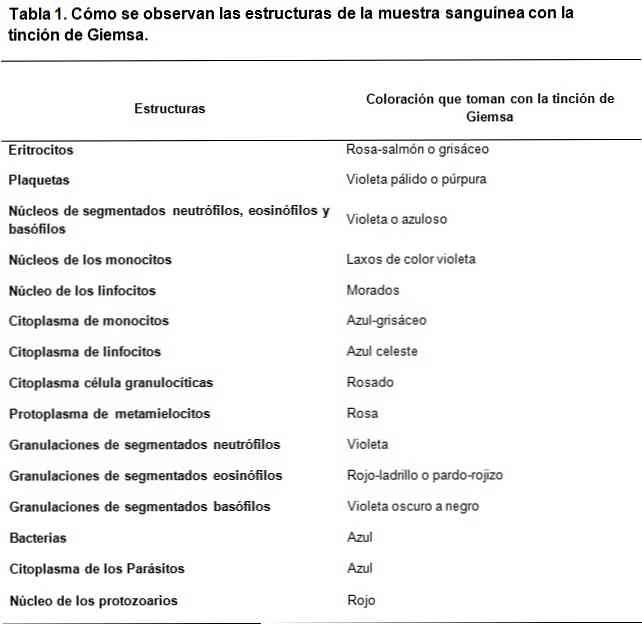
Technika barwienia Giemsa jest bardzo przydatna w badaniach cytologicznych, ponieważ umożliwia obserwację specyficznych struktur komórek. Ta technika barwi cytoplazmy, jądra, jądra, wakuole i granulki komórek, będąc w stanie odróżnić nawet drobne ślady chromatyny.
Ponadto można wykryć znaczące zmiany w wielkości, kształcie lub zabarwieniu jądra, gdzie możliwe jest zwizualizowanie utraty relacji jądro-cytoplazma.
Z drugiej strony, pozwala zidentyfikować niedojrzałe komórki w szpiku kostnym i krwi obwodowej, co jest ważne w diagnostyce poważnych chorób, takich jak białaczka. Możliwe jest również wykrywanie hemoparytów, między innymi bakterii wewnątrzkomórkowych, grzybów.
W cytogenetyce jest on dość powszechnie stosowany, ponieważ możliwe jest badanie mitozy komórek.
Indeks
- 1 Podstawa zabarwienia Giemsy
- 2 Materiały
- 2.1 Materiały do przygotowania roztworu macierzystego
- 2.2 Tryb przygotowania roztworu macierzystego
- 2.3 Materiały do przygotowania roztworu buforowego
- 2.4 Końcowe przygotowanie barwnika
- 2.5 Dodatkowe materiały potrzebne do wykonania zabarwienia
- 3 Technika
- 3.1 Proces barwienia
- 4 Narzędzia
- 4.1 Hematologia
- 4.2 Mykologia
- 4.3 Bakteriologia
- 4.4 Parazytologia
- 4.5 Cytologia
- 4.6 Cytogenetyka
- 5 Badania wykazujące skuteczność barwienia Giemsa
- 6 Zalecenia dotyczące dobrego barwienia
- 7 Częste błędy w kolorowaniu Giemsy
- 7.1 Niezwykle niebieskie zabarwienie
- 7.2 Nadmiernie różowa kolorystyka
- 7.3 Obecność osadów w rozmazie
- 7.4 Obecność artefaktów morfologicznych
- 8 Tryb pamięci
- 9 Odniesienia
Podstawa zabarwienia Giemsy
Barwniki typu Romanowsky'ego opierają się na zastosowaniu kontrastu między barwnikami kwasowymi i zasadowymi, w celu uzyskania odpowiednio barwienia struktur zasadowych i kwasowych. Jak widać, istnieje powinowactwo barwników kwasowych do barwienia podstawowych struktur i odwrotnie.
Podstawowym barwnikiem stosowanym jest błękit metylenowy i jego utlenione pochodne (Azure A i Azure B), podczas gdy barwnikiem kwasowym jest eozyna.
Kwasowymi strukturami komórek są między innymi kwasy nukleinowe, granulki segmentowanych bazofilów, dlatego będą barwione błękitem metylenowym.
W tym samym sensie podstawowymi strukturami komórek są hemoglobina i niektóre granulki, takie jak te zawarte między innymi w segmentowanych eozynofilach; będą one barwione eozyną.
Z drugiej strony, ze względu na fakt, że błękit metylenowy i lazur charakteryzują się barwnikami metachromatycznymi, mogą one dostarczać zmienne tony różnym strukturom w zależności od obciążenia posiadanych polianionów..
W ten sposób strategiczna kombinacja barwników podstawowych i kwasowych jest w stanie rozwinąć szerokie spektrum kolorów, zgodnie z cechami biochemicznymi każdej struktury, przechodząc przez jasnoniebieskie, ciemnoniebieskie, liliowe i fioletowe odcienie w przypadku struktur kwasowych.
Podczas gdy zabarwienie zapewniane przez eozynę jest bardziej stabilne, generuje kolory między czerwonawo-pomarańczowym a łososiem.
Materiały
Materiały do przygotowania roztworu macierzystego
Przygotowanie roztworu podstawowego wymaga odważenia 600 mg sproszkowanego barwnika Giemsa, odmierzenia 500 cm3 wolnego od acetonu alkoholu metylowego i 50 cm3 obojętnej gliceryny.
Tryb przygotowania roztworu macierzystego
Umieść ciężki proszek Giemsa w moździerzu. Jeśli są grudki, należy je spryskać. Następnie dodaj znaczną ilość zmierzonej gliceryny i dobrze wymieszaj. Otrzymaną mieszaninę wlewa się do bardzo czystej bursztynowej butelki.
Resztę gliceryny umieszcza się w moździerzu. Wymieszaj ponownie, aby wyczyścić pozostały barwnik, który przykleił się do ścian zaprawy i wlej do tej samej butelki.
Butelka jest przykryta i noszona przez 2 godziny w łaźni wodnej o temperaturze 55 ° C. Podczas kąpieli w gorącej wodzie mieszaj lekko mieszankę co pół godziny.
Następnie mieszaninę pozostawia się do ostygnięcia, aby umieścić alkohol. Wcześniej część mierzonego alkoholu umieszcza się w moździerzu, aby dokończyć przemywanie resztek barwnika, a następnie dodaje się go do mieszaniny razem z resztą alkoholu.
Preparat należy pozostawić do dojrzewania przez co najmniej 2 tygodnie. Część użyta roztworu macierzystego musi zostać przefiltrowana.
Aby uniknąć zanieczyszczenia preparatu, zaleca się przekazanie porcji, która będzie w ciągłym użyciu, do małej bursztynowej butelki z zakraplaczem. Ładuj za każdym razem, gdy skończy się odczynnik.
Materiały do przygotowania roztworu buforowego
Z drugiej strony roztwór buforowy o pH 7,2 przygotowuje się w następujący sposób:
Odważa się 6,77 grama fosforanu sodu (bezwodny) (NaHPO4), 2,59 g dwuwodorofosforanu potasu (KH)2PO4) i woda destylowana do 1000 cm3.
Końcowe przygotowanie barwnika
W celu przygotowania końcowego roztworu do barwienia mierzy się 2 cm3 przefiltrowanego roztworu podstawowego i miesza z 6 cm3 roztworu buforowego. Mieszaninę miesza się.
Istotnym faktem, który należy wziąć pod uwagę, jest to, że techniki przygotowania barwnika mogą się zmieniać w zależności od domu handlowego.
Dodatkowe materiały potrzebne do wykonania zabarwienia
Poza opisanymi materiałami, powinien być wyposażony w kolorowe mostki, ekrany wodne lub bufor do mycia, arkusze na przedmioty lub okładki, stoper do kontrolowania czasów barwienia i bibuły lub jakiś materiał, który może być użyty do wyschnięcia ( gaza lub bawełna).
Technika
Proces barwienia
1) Przed farbowaniem próbkę należy rozprowadzić na czystym szkiełku..
Próbkami mogą być krew, szpik kostny, kawałki tkanek histologicznych lub próbki szyjki macicy i pochwy. Zaleca się, aby powierzchnie zewnętrzne były cienkie i miały 1 lub 2 godziny suszenia przed ich zabarwieniem.
2) Wszystkie arkusze, które musisz pokolorować, są umieszczane na kolorowym moście. Zawsze pracuj w tej samej kolejności i dobrze identyfikuj każdy arkusz.
3) Umieść kilka kropli 100% alkoholu metylowego (metanolu) na rozmazie i pozostaw na 3 do 5 minut w celu utrwalenia i odwodnienia próbki.
4) Odrzucić metanol obecny w arkuszu i pozostawić do wyschnięcia na powietrzu.
5) Po wyschnięciu umieścić końcowy roztwór barwiący zakraplaczem, aż cały arkusz zostanie przykryty. Pozostaw na 15 minut. Niektórzy autorzy zalecają do 25 min. Zależy od domu handlowego.
6) Opróżnij barwnik i wymyj wymaz wodą destylowaną lub roztworem buforowym 7.2.
7) Na bibule pozostaw arkusze do wyschnięcia na wolnym powietrzu, ułożone pionowo przy pomocy podpory.
8) Wytrzyj tylną część slajdu gazą lub bawełnianym wacikiem zwilżonym alkoholem, aby usunąć pozostały barwnik.
Narzędzia
Technika barwienia Giemsa jest stosowana w kilku obszarach, w tym: hematologia, mikologia, bakteriologia, parazytologia, cytologia i cytogenetyka.
Hematologia
Jest to najczęstsze narzędzie, które nadaje się temu zabarwieniu. Dzięki niemu możemy zidentyfikować każdą z komórek obecnych w próbkach szpiku kostnego lub krwi obwodowej. Jak również oszacowanie liczby każdej serii, możliwość wykrycia leukocytozy lub leukopenii, małopłytkowości itp..
Ponieważ jest wrażliwy na identyfikację niedojrzałych komórek, ma znaczenie w rozpoznawaniu ostrych lub przewlekłych białaczek. Można również zdiagnozować niedokrwistość, taką jak między innymi niedokrwistość sierpowatokrwinkowa, niedokrwistość sierpowata..
Mykologia
W tym obszarze często używa się go do wyszukiwania Histoplasma capsulatum (wewnątrzkomórkowy grzyb dimorficzny) w próbkach tkanek.
Bakteriologia
W rozmazach hematologicznych wybarwionych preparatem Giemsa możliwe jest wykrycie Borrelias sp u pacjentów z chorobą zwaną nawrotem gorączki. Krętki występują obficie w erytrocytach, w próbkach pobranych na szczycie gorączki.
Można również wizualizować bakterie wewnątrzkomórkowe Rickettsias sp i Chlamydia trachomatis w zainfekowanych komórkach.
Parazytologia
W dziedzinie parazytologii barwienie Giemsa pozwoliło na rozpoznanie chorób pasożytniczych, takich jak malaria, choroba Chagasa i leiszmanioza..
W pierwszych dwóch pasożytach Plasmodium sp i Trypanosoma cruzi odpowiednio można je wizualizować w krwi obwodowej zakażonych pacjentów, można je znaleźć na różnych etapach w zależności od fazy, w której choroba jest.
Aby poprawić poszukiwania pasożytów krwi, zaleca się stosowanie barwnika Giemsa zmieszanego z barwnikiem May-Grünwald.
Podobnie, leiszmaniozę skórną można zdiagnozować podczas oceny próbek biopsji skóry barwionych Giemsa, gdzie znajduje się pasożyt.
Cytologia
Barwienie Giemsa jest również wykorzystywane do badania cytologicznego próbek szyjki macicy, chociaż nie jest to najczęściej stosowana technika w tym celu.
Jednak w przypadkach niedoboru zasobów można użyć funkcji podobnej do tej oferowanej przez technikę Papanicolaou i przy niższych kosztach. Wymaga to jednak doświadczenia ze strony egzaminatora.
Cytogenetyka
Istotną cechą barwienia Giemsa jest jego zdolność do silnego wiązania się z regionami bogatymi w adeniny DNA i tyminy. Pozwala to na wizualizację DNA podczas mitozy komórek, w różnych stanach kondensacji.
Badania te są niezbędne do wykrycia aberracji chromatycznych, takich jak duplikacje, delecje lub translokacje różnych regionów chromosomów..
Badania wykazujące skuteczność barwienia Giemsa
Cannova i in. (2016) porównali 3 techniki barwienia w diagnostyce leiszmaniozy skórnej.
W tym celu wykorzystali próbki uzyskane od zwierzęcia doświadczalnego (Mesocrisetus auratus) eksperymentalnie zaszczepiony Leishmanias.
Autorzy wykazali, że barwienie Giemsa było lepsze niż barwienie Pap-mart® i Gaffney. Dlatego uważali, że bejca Giemsa jest idealna do diagnozowania leiszmaniozy skórnej.
Doskonałe wyniki uzyskane przez autorów wynikają z faktu, że kombinacja barwników, z których składa się mieszanina Giemsy, stwarza warunki konieczne do stworzenia korzystnego kontrastu, umożliwiając wyraźne odróżnienie struktur amastigote, zarówno wewnątrz jak i zewnątrzkomórkowo..
Inne techniki (Pap-mart® i Gaffney) również to zrobiły, ale w słabszy sposób i dlatego trudniej je wyobrazić. Dlatego zaleca się stosowanie barwnika Giemsa do diagnostyki parazytologicznej leiszmaniozy.
Podobnie badanie Ramíreza i wsp. (1994) oceniało zasadność plam Giemsy i Lendrum w rozmazach spojówkowych w celu identyfikacji Chlamydia trachomatis.
Autorzy ustalili, że barwienie Giemsa i Ledrum ma tę samą specyfikę, ale Giemsa był bardziej wrażliwy.
To wyjaśnia, dlaczego obecnie barwienie Giemsa jest najczęściej stosowane do diagnozowania zakażeń chlamydiami, zwłaszcza jeśli jest niewiele zasobów.
Zalecenia dotyczące dobrego barwienia
Suszenie arkuszy nie powinno być przyspieszane. Oczekiwanie na ostrożność musi nastąpić w celu wysuszenia go na świeżym powietrzu. Około 2 godzin.
Kolor natychmiast po 2 godzinach dla uzyskania najlepszych rezultatów.
Aby smugi były utrwalone i lepiej zabarwione, próbka musi być rozłożona na arkuszu w taki sposób, aby pozostała cienka i jednolita warstwa.
Preferowaną próbką krwi jest kapilara, ponieważ rozmaz powstaje bezpośrednio z kropli krwi, a zatem próbka nie ma dodatku, co sprzyja utrzymaniu struktur komórkowych.
Jeśli jednak stosuje się krew żylną, EDTA powinien być stosowany jako antykoagulant, a nie heparyna, ponieważ ta ostatnia zazwyczaj deformuje komórki.
Typowe błędy w kolorowaniu Giemsy
W praktyce tego kolorowania można popełnić błędy. Świadczą o tym nagłe zmiany odcieni struktur.
Niezwykle niebieski koloryt
Może to być spowodowane:
- Bardzo grube rozmazy
- Przekroczenie czasu barwienia
- Zbyt mało prania.
- Stosowanie odczynników znacznie powyżej pH neutralnego (alkalicznego).
W tych warunkach kolory następujących struktur są zniekształcone, tak że erytrocyty zamiast śmierci różowo-łososiowej będą wyglądać na zielone, granulki eozynofili, które powinny być zabarwione czerwoną cegłą, zmienią kolor na niebieski lub szary i tak dalej będzie odchylenie w zwykłych tonach.
Nadmiernie różowe zabarwienie
Może to być spowodowane:
- Niewystarczający czas barwienia.
- Długotrwałe lub nadmierne mycie.
- Złe suszenie.
- Stosowanie bardzo kwaśnych odczynników.
W tym konkretnym przypadku struktury, które normalnie są zabarwione na niebiesko, nie będą prawie widoczne, podczas gdy struktury zabarwione na różowo będą miały bardzo przesadne tonacje.
Przykład: erytrocyty przyjmą jasnoczerwony lub silny kolor pomarańczowy, chromatyna jądrowa będzie wyglądać blado różowo, a granulki eozynofili staną się jaskrawoczerwone..
Obecność osadów w rozmazie
Przyczynami mogą być:
- Używaj brudnych lub słabo umytych prześcieradeł.
- Nie pozwól, aby rozmaz dobrze wyschnął.
- Pozostaw rozwiązanie naprawcze zbyt długo.
- Nieodpowiednie mycie pod koniec barwienia.
- Niewystarczająca filtracja lub brak filtracji stosowanego barwnika.
Obecność artefaktów morfologicznych
Artefakty morfologiczne mogą pojawiać się w rozmazach, utrudniając wizualizację i interpretację obecnych struktur. Wynika to z:
- Rodzaj stosowanego antykoagulantu, takiego jak heparyna.
- Stosowanie brudnych, uszkodzonych lub tłustych arkuszy.
Tryb przechowywania
Po przygotowaniu barwnik należy przechowywać w temperaturze pokojowej (15 - 25 ° C), aby zapobiec wytrącaniu się barwnika. Musi być przechowywany w zamkniętym bursztynowym pojemniku.
Referencje
- Cannova D, Brito E i Simons M. Ocena technik barwienia w diagnostyce leiszmaniozy skórnej. Salus. 2016; 20 (2): 24-29.
- Odczynniki PanReac Applichem ITW. Plama Giemsa. Wersja 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Hiszpania.
- Procedury barwienia Clarka G. (1981), 4 tryby. Williams i Willkins.
- Applied Clinical Chemistry Barwnik Giemsa do diagnozy in vitro. Dystrybutor: cromakit.es
- Ramírez I, Mejía M, García de la Riva J, Hermes F i Grazioso C. Ważność plam Giemsy i Lendrum w rozmazach spojówkowych w celu identyfikacji Chlamydia trachomatis. Bol z Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. General Mycology. 1994. Wydanie drugie Universidad Central de Venezuela, wydania biblioteczne. Wenezuela, Caracas.
- „Plama Giemsa”. Wikipedia, darmowa encyklopedia. 1 września 2017 r., 01:02 UTC. 6 grudnia 2018, en.wikipedia.org.


