Fundament, techniki i zastosowania barwienia zarodnikami
The barwienie zarodników jest metodologią stosowaną do barwienia struktur oporowych, które tworzą niektóre rodzaje bakterii, gdy są one w niekorzystnych warunkach; te struktury odpowiadają sposobowi przetrwania.
Istnieje wiele rodzajów, które tworzą zarodniki; jednak głównymi są Bacillus i Clostridium. Te rodzaje są uważane za bardziej istotne, ponieważ mają gatunki chorobotwórcze dla ludzi.
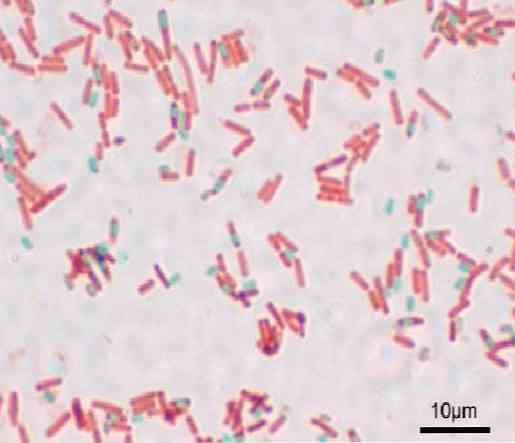
Każdy Bacillus może dać początek zarodnikowi. W momencie barwienia preparatu przetrwalnik można znaleźć wewnątrz Bacillus (endospore) lub poza nim (exospore). W przypadku konwencjonalnych technik barwienia bakterii - takich jak barwienie metodą Grama - zarodniki pozostają bezbarwne.
Obecnie istnieje kilka metod kolorowania, które są w stanie przekroczyć grubą strukturę zarodnika, aby go farbować. Te metodologie są bardzo zróżnicowane; wśród nich można wymienić technikę Dornera, barwę Möellera i metodologię Shaeffera-Fultona, znaną również jako Wirtz-Conklin..
Spośród wszystkich wymienionych technik metodologia Shaeffera-Fultona jest najczęściej stosowana w rutynowych laboratoriach. Swoją nazwę zawdzięcza dwóm mikrobiologom, którzy stworzyli kolor w 1930 roku: Alicia Shaeffer i MacDonald Fulton. Jednak czasami technika ta nazywana jest Wirtz-Conklin na cześć dwóch bakteriologów z XX wieku.
Indeks
- 1 Fundacja
- 2 Techniki barwienia zarodników
- 2.1 Technika Dornera
- 2.2 Zmodyfikowana technika Dornera
- 2.3 Technika Shaeffer-Fulton lub Wirtz-Conklin
- 2.4 Technika Möellera
- 2.5 Zmodyfikowana technika Möellera bez ciepła
- 3 zastosowania
- 3.1 Przykłady
- 4 odniesienia
Fundacja
Zarodniki nie plamią się konwencjonalnymi kolorami, ponieważ mają bardzo grubą ścianę. Złożony skład zarodników uniemożliwia wejście większości barwników.
Jeśli zarodniki są badane od zewnątrz do wewnątrz, obserwuje się następujące warstwy: po pierwsze, exosporium, które jest najcieńszą warstwą zewnętrzną utworzoną przez glikoproteiny..
Potem pojawia się naskórek, który zapewnia odporność na wysokie temperatury, a następnie kora składa się z peptydoglikanu. Następnie znajduje się ściana podstawy, która chroni protoplasty.
Zarodnik jest odwodnioną strukturą zawierającą 15% wapnia i kwasu dipikolinowego. Dlatego większość technik barwienia zarodników opiera się na stosowaniu ciepła, dzięki czemu barwnik może penetrować grubą strukturę.
Gdy zarodnik jest farbowany, nie może wyeliminować barwnika. W technice Shaeffera-Fultona zieleń malachitowa wchodzi do komórek wegetatywnych i po zastosowaniu ciepła przenika przez endosporę, a także przez egzospory.
Podczas mycia wodą barwnik usuwa się z komórki wegetatywnej. Dzieje się tak, ponieważ zielony barwnik malachitowy jest nieco zasadowy, więc wiąże się słabo z komórką wegetatywną.
Z drugiej strony, nie może wydostać się z zarodników, a na koniec bakteria z safraniną jest skontrastowana. Ta podstawa jest ważna dla pozostałych technik, w których dzieje się coś podobnego.
Techniki barwienia zarodników
Aby zabarwić zarodniki, musisz mieć czystą kulturę podejrzanego szczepu, który chcesz badać.
Hodowlę poddaje się ekstremalnym temperaturom przez 24 godziny, aby stymulować mikroorganizmy do zarodnikowania. W tym celu hodowlę można umieścić w piecu w 44 ° C lub w lodówce (8 ° C) na 24 lub 48 godzin.
Jeśli pozostanie zbyt wiele czasu w wymienionych temperaturach, zaobserwowane zostaną tylko egzospory, ponieważ wszystkie endospory pozostaną Bacillus.
Pod koniec czasu kilka kropli sterylnego roztworu fizjologicznego należy umieścić na czystym szkiełku. Następnie pobiera się niewielką część plonu i wykonuje się drobny rozrzut.
Następnie pozostawia się do wyschnięcia, przymocowuje się do ciepła i barwi niektórymi z poniższych technik:
Technika Dornera
1- Przygotuj w probówce stężoną zawiesinę sporulowanego mikroorganizmu w wodzie destylowanej i dodaj równą objętość przefiltrowanej fuksyny fenolowej Kinyoun.
2- Umieścić probówkę w kąpieli z wrzącą wodą przez 5 do 10 minut.
3- Na czystym szkiełku wymieszać kroplę poprzedniej zawiesiny z kroplą 10% wodnego roztworu nigrozyny, zagotować i przefiltrować.
4- Wydłuż i wysusz szybko z łagodnym ciepłem.
5- Badanie z obiektywem 100X (zanurzenie).
Zarodniki barwią się na czerwono, a komórki bakteryjne wydają się prawie bezbarwne na ciemnym szarym tle.
Zmodyfikowana technika Dornera
1- Zawiesina sporulowanego mikroorganizmu jest rozprowadzana na szkiełku i mocowana do ciepła.
2- Próbka jest pokryta paskiem bibuły filtracyjnej, do której dodaje się fuksynę kwasu fenowego. Barwnik ogrzewa się przez 5 do 7 minut za pomocą płomienia palnika Bunsena, aż do wytworzenia się oparów. Następnie papier zostanie usunięty.
3- Przemyj preparat wodą, a następnie osusz go bibułą.
4- Przykryj rozmaz cienką warstwą 10% nigrosin, używając drugiego szkiełka do rozprowadzenia nigrosin lub igły.
Zabarwienie zarodników i bakterii jest takie samo, jak opisane w stanie techniki.
Technika Shaeffera-Fultona lub Wirtza-Conklina
1- Zrób cienki środek do smarowania z zawiesiną sporulowanego mikroorganizmu na szkiełku i przymocuj go do ciepła.
2- Przykryć szkiełko wodnym roztworem 5% zieleni malachitowej (na arkuszu można umieścić bibułę filtracyjną).
3 - Podgrzać płomień palnika Bunsena, aby spowodować wydostanie się pary i usunięcie płomienia. Powtórz operację przez 6 do 10 minut. Jeśli podczas procedury zielony roztwór malachitu wyparuje zbyt wiele, można dodać więcej.
4- Wyjmij bibułę filtracyjną (jeśli została umieszczona) i umyj wodą.
5- Przykryć szkiełko 0,5% wodnym safraniną przez 30 sekund (niektóre warianty techniki wykorzystują 0,1% wodny safranin i pozostawić na 3 minuty).
Dzięki tej technice zarodniki są zielone, a laseczki czerwone.
Wadą jest to, że endospory młodych kultur nie barwią się dobrze, ponieważ wyglądają wyjątkowo klarownie lub bezbarwnie. Aby tego uniknąć, zaleca się stosowanie kultur 48-godzinnej inkubacji.
Technika Möellera
1- Przykryć rozmaz chloroformem przez 2 minuty.
2- Odrzucić chloroform.
3- Pokryć 5% kwasem chromowym przez 5 minut.
4- Umyć wodą destylowaną
5- Arkusz jest pokryty karpiem fuksjowo-fenolowym i wystawiony na działanie płomienia palnika Bunsena do momentu emisji oparów; następnie jest usuwany z płomienia na kilka chwil. Operacja jest powtarzana, aż osiągnie 10 minut.
6- Umyć wodą.
7- Używać zakwaszonego etanolu (alkoholu chlorowodorowego) do odbarwienia. Zostaje na 20 lub 30 sekund.
8- Umyć wodą destylowaną.
9- Przeciwdziałać pokryciu blachy błękitem metylenowym przez 5 minut.
10- Umyć wodą destylowaną.
11- Pozostawia się do wyschnięcia i próbkę pobiera się pod mikroskopem.
Zarodniki wyglądają jak czerwone i niebieskie pałeczki. Ważne jest, aby nie wdychać oparów, ponieważ są one toksyczne iw dłuższej perspektywie mogą być rakotwórcze.
Zmodyfikowana technika Möellera bez ciepła
W 2007 roku Hayama i jego współpracownicy stworzyli modyfikację techniki Möellera. Usunęli etap ogrzewania barwnika i zastąpili go dodatkiem 2 kropli środka powierzchniowo czynnego Tergitol 7 na każde 10 ml fuksynowo-fenolowego roztworu karbolowego. Uzyskano te same wyniki.
Używa
Kolorowanie zarodników dostarcza bardzo cennych i użytecznych informacji do identyfikacji patogenu, ponieważ obecność tego samego, jego kształtu, położenia w obrębie pałeczki i zdolności do deformacji komórki wegetatywnej lub nie, są danymi, które mogą kierować gatunkiem zaangażowany w określonej płci.
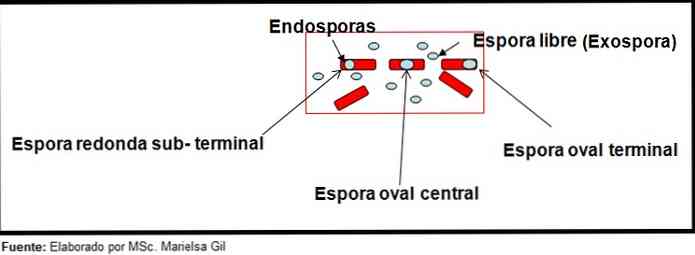
W tym kontekście warto wspomnieć, że zarodniki mogą być okrągłe lub owalne, mogą znajdować się w środku lub też w pozycji paracentralnej, subterminal lub terminalu.
Przykłady
- Clostridium difficile tworzy owalny zarodnik w pozycji końcowej, który deformuje prątek.
- Zarodnik Clostridium tertium Jest owalny, nie deformuje prątka i znajduje się na poziomie terminalu.
- Endospore z Clostridium tetani jest on końcowy i deformuje Bacillus, dając wygląd pałki.
- Zarodniki Clostridium botulinum, C. histolyticum, C. novy i C. septicum są okrągłe lub subterminal owalne i deformują Bacillus.
- Endospore z Clostridium sordelli znajduje się w pozycji centralnej, z niewielkim odkształceniem.

Referencje
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Propozycja uproszczonej techniki barwienia przetrwalników bakteryjnych bez zastosowania udanej modyfikacji metody Moellera. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Twórcy Wikipedii. Plama Moellera. Wikipedia, wolna encyklopedia. 3 listopada 2018, 03:28 UTC. Dostępne na: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Podręcznik laboratoryjny technik mikrobiologicznych. Katedra Nauk Podstawowych Akademii Mikrobiologii. Narodowy Instytut Politechniczny.
- „Endospora”. Wikipedia, darmowa encyklopedia. 25 lutego 2018, 10:20 UTC. 10 stycznia 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J i współpracownicy. (2006). Personel roboczy wspólnoty autonomicznej Estremadura. Szczegółowy program Tom IV. Redakcja MAD. Sewilla-Hiszpania, s. 211–212.
- Silva M., García M., Corrales J., Ponce E. (2006). Specjalistyczny technik laboratoryjny Galicyjskiej Służby Zdrowia (SERGAS). Zakres tematyczny tom 2. Redakcja MAD. Sewilla-Hiszpania, str. 79–80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostyka mikrobiologiczna. (5 wyd.). Argentyna, redakcja Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Diagnostyka mikrobiologiczna Bailey & Scott. 12 ed. Argentyna Panamericana S.A Editorial


