Podłoże agarowe, zastosowanie i przygotowanie
The agar krwi jest to wzbogacone podłoże stałe, różnicowe, ale nie selektywne. Jest on stosowany do odzyskiwania i wzrostu wielu różnych mikroorganizmów z próbek klinicznych lub subkultur.
Do posiewu większości próbek klinicznych otrzymanych w laboratorium należy dołączyć klasyczny agar z krwią; z wyjątkiem próbek stolca, gdzie nie jest przydatna, chyba że przygotowano z pewnymi modyfikacjami.
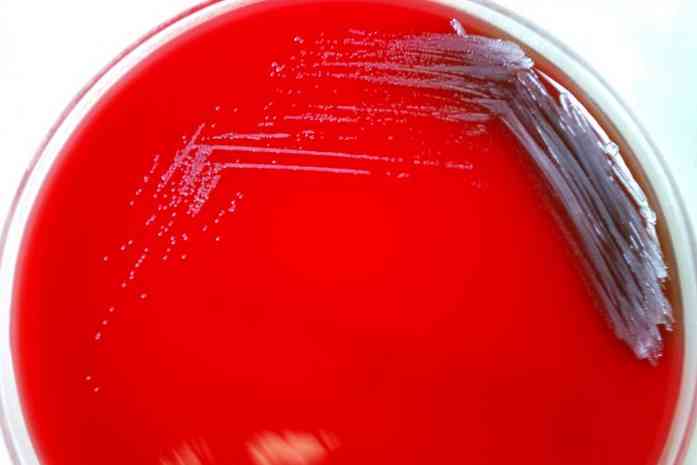
Ta pożywka hodowlana składa się zasadniczo ze wzbogaconego agaru zasadowego i 5% krwi. Baza agaru może się różnić w zależności od potrzeb, ale głównie składa się z peptonów, aminokwasów, witamin, ekstraktu mięsnego, chlorku sodu, agaru, między innymi.
Jeśli chodzi o krew, zazwyczaj wymaga się kontaktu z bioterią w celu uzyskania krwi od zwierząt, takich jak owce, króliki lub konie. Jednak nie zawsze jest to możliwe, a czasami używa się ludzkiej krwi.
Podłoże agarowe z krwią można przygotować w laboratorium lub można je kupić gotowe dla firm, które są do tego dedykowane. Przygotowanie tego medium jest jednym z najdelikatniejszych, każda niedbałość w jego przygotowaniu spowoduje zanieczyszczenie partii.
Dlatego należy podjąć wszelkie możliwe środki ostrożności, a na koniec należy przeprowadzić kontrolę jakości inkubacji w 37 ° C 1 płytkę na każde 100 przygotowanych.
Indeks
- 1 Fundacja
- 2 zastosowania
- 2.1 Wybór grupy krwi
- 2.2 Wybór typu agaru bazowego
- 2.3 Zastosowania agaru z krwią zgodnie z podłożem podstawowym stosowanym do jego przygotowania
- 3 Przygotowanie
- 3.1 Zważyć i rozpuścić
- 3.2 Sterylizacja
- 3.3 Agregacja krwi
- 3.4 Wlać na szalki Petriego
- 4 odniesienia
Fundacja
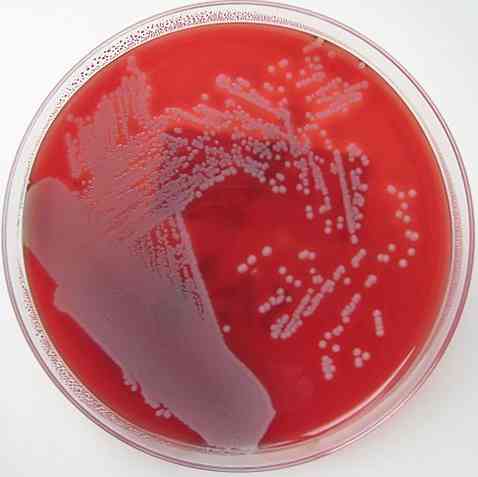 Wspomniano już, że agar z krwią ma charakter wzbogaconej, zróżnicowanej i nieselektywnej pożywki. Podstawa każdej z tych właściwości jest wyjaśniona poniżej.
Wspomniano już, że agar z krwią ma charakter wzbogaconej, zróżnicowanej i nieselektywnej pożywki. Podstawa każdej z tych właściwości jest wyjaśniona poniżej.
Agar z krwią jest wzbogaconym podłożem, ponieważ ma jako główny dodatek 5-10% krwi na podłożu agarowym. Oba związki zawierają wiele składników odżywczych i ta właściwość pozwala na wzrost większości bakterii uprawnych.
Ten wzrost następuje bez ograniczeń; z tego powodu jest nieselektywny. Jeśli jednak do tego medium dodaje się związki, które zapobiegają wzrostowi niektórych mikroorganizmów i sprzyjają rozwojowi innych, stają się selektywne. Jest tak w przypadku dodania pewnych rodzajów antybiotyków lub środków przeciwgrzybiczych.
Podobnie agar z krwią jest podłożem różnicowym, ponieważ pozwala odróżnić 3 typy bakterii: beta-hemolityczną, alfa-hemolityczną i gamma-hemolityczną..
Beta-hemolityki to takie, które mają zdolność do lizy lub całkowitego zerwania czerwonych krwinek, tworząc wyraźną aureolę wokół kolonii, co powoduje hemolizę β lub β - hemoliza, a mikroorganizmy są nazywane ß-hemolizą.
Przykładami bakterii ß-hemolitycznych są Streptococcus pyogenes i Streptococcus agalactiae.
Hemolityki alfa to te, które wykonują częściową hemolizę, w której hemoglobina jest utleniana do methemoglobiny, tworząc zielonkawe zabarwienie wokół kolonii. Zjawisko to znane jest jako hemoliza α lub hemoliza α, a bakterie są klasyfikowane jako α-hemolityczne.
Przykładami bakterii α-hemolizujących są Streptococcus pneumoniae i Streptococcus grupy viridans.
Wreszcie, istnieją bakterie zwane gamma-hemolityczne lub niehemolityczne. Rosną one na agarze bez generowania na nim zmian, efekt znany jako γ -hemoliza, a mikroorganizmy są γ -hemolityczne.
Przykład γ-bakteryjnych bakterii: niektóre szczepy Streptococcus z grupy D (Streptococcus bovis i Enterococcus faecalis).
Używa
Pożywka agarowa z krwią jest jednym z najczęściej stosowanych w laboratorium mikrobiologicznym.
Wśród mikroorganizmów zdolnych do wzrostu na podłożu agarowym z krwią znajdują się: bakterie tlenowe tlenowe, fakultatywne, mikroaerofilne, beztlenowe, Gram-dodatnie lub Gram-ujemne, bakterie szybko rosnące lub wolno rosnące.
Rosną również niektóre bakterie wymagające lub uciążliwe z punktu widzenia żywieniowego, a także grzyby i drożdże. Podobnie jest użyteczny do subkultury lub reaktywacji szczepów, które są bardzo słabe metabolicznie.
Jednak wybór grupy krwi i agaru podstawowego będzie się różnić w zależności od prawdopodobnego drobnoustroju podejrzewanego o powrót do zdrowia i zastosowania płytki nazębnej (kultury lub antybiogramu)..
Wybór grupy krwi
Krew może być barankiem, królikiem, koniem lub człowiekiem.
Najbardziej zalecana jest krew jagnięca, z pewnymi wyjątkami. Na przykład, aby wyizolować gatunki Haemophilus, gdzie zalecaną krwią jest koń lub królik, ponieważ krew baranka ma enzymy, które hamują czynnik V.
Najmniej zalecany jest człowiek, jednak jest on najczęściej używany, być może dlatego, że jest najłatwiejszy do uzyskania.
Krew musi być defibrynowana, uzyskana bez żadnego dodatku i od zdrowych zwierząt. Aby użyć ludzkiej krwi, należy wziąć pod uwagę kilka czynników:
Jeśli krew pochodzi od osób, które doznały infekcji bakteryjnych, będą miały swoiste przeciwciała. W tych warunkach wzrost niektórych bakterii prawdopodobnie zostanie zahamowany.
Jeśli jest otrzymywany z banku krwi, zawiera cytrynian i możliwe jest, że niektóre bakterie nie rozwiną się w jego obecności. Z drugiej strony, jeśli krew pochodzi od pacjentów przyjmujących antybiotyki, wzrost podatnych bakterii może zostać zahamowany.
A jeśli krew pochodzi od osoby z cukrzycą, nadmiar glukozy zakłóca prawidłowy rozwój wzorców hemolizy.
Wybór typu agaru bazowego
Podstawowy agar stosowany do przygotowania agaru z krwią może być bardzo szeroki. Należą do nich: agar odżywczy, agar z sercem do infuzji mózgowej, agar sojowy z tryptozą, agar Müeller Hinton, agar Thayer Martin, agar Columbia, agar Brucella, agar Campylobacter itp..
Zastosowania agaru z krwią według podłoża podstawowego użytego do jego przygotowania
Agar odżywczy
Ta baza jest najmniej używana, ponieważ na niej rosną głównie mało wymagające bakterie, takie jak pałeczki jelitowe, Pseudomonas sp, S. aureus, Bacillus sp, między innymi. Nie zaleca się izolowania Streptococcus.
Heart Brain Infusion Agar (BHI)
Jest jednym z najczęściej używanych jako podstawa agaru z krwią, ponieważ zawiera niezbędne składniki odżywcze do wzrostu większości bakterii, w tym Streptococcus sp i inne wymagające bakterie. Chociaż nie jest właściwe obserwowanie wzorców hemolizy.
Z tą bazą zazwyczaj używa się krwi jagnięcej.
Można również przygotować warianty agaru z krwią, w których dodaje się inne związki w celu wyizolowania pewnych mikroorganizmów. Na przykład, agar z sercem do infuzji mózgu uzupełniony krwią królika, cystyną i glukozą, służy do izolowania Francisella tularensis.
Natomiast z cystyną telluryt jest przydatny do izolacji Corynebacterium diphteriae. Możesz użyć krwi ludzkiej lub baranka.
Przy pierwszej beta-hemoliza będzie wyglądać jak wąska aureola, podczas gdy druga będzie znacznie szersza.
Podobnie, ta baza wraz z bacytracyną, skrobią kukurydzianą, krwią końską i innymi suplementami wzbogacającymi (IsoVitaleX) jest stosowana do izolacji rodzaju Haemophilus sp z próbek oddechowych.
Ponadto, jeśli dodasz kombinację antybiotyków chloramfenikolu - gentamycyny lub penicyliny - streptomycyny z końską krwią, jest ona idealna do izolacji wymagających grzybów chorobotwórczych, nawet z wyższą wydajnością niż agar glukozowy Sabouraud. Jest to szczególnie przydatne w izolacji Histoplasma capsulatum.
Tryptive soja
Ta baza jest najbardziej zalecana dla lepszej obserwacji wzorca hemolizy i wykonywania testów diagnostycznych, takich jak taksony optoquiny i bacytracyny. Jest to klasyczny agar z krwią, który jest używany rutynowo.
Dzięki tej bazie możesz również przygotować specjalny agar z krwią Corynebacterium diphteriae, z tellurium cystyną i krew baranka.
Podobnie połączenie tego agaru z krwią jagnięcą i kanamycyną-wankomycyną jest idealne do wzrostu beztlenowców, zwłaszcza Bacteroides sp.
Agar Müeller Hinton
Ta baza uzupełniona krwią służy do wykonania antybiogramu wymagających mikroorganizmów, takich jak Streptococcus sp.
Jest również przydatny do izolacji bakterii takich jak Legionella pneumophila.
Agar Thayer Martin
To podłoże jest idealne jako podłoże dla agaru z krwią, gdy podejrzewa się rodzaj Neisseria Neisseria meningitidis, od N. gonorrhoeae nie rośnie na agarze z krwią.
Służy również do wykonywania testów podatności na Neisseria meningitidis.
Agar Columbia
Ta baza jest doskonała do wysiewania próbek biopsji żołądka w poszukiwaniu Helicobacter pylori.
Pożywkę przygotowuje się przez dodanie 7% krwi jagnięcej defibryfikowanej antybiotykami (wankomycyna, trimetoprim, amfoterycyna B i cefsulodyna), aby ograniczyć wzrost innych rodzajów bakterii, które mogą być obecne.
Ta sama zasada uzupełniona krwią ludzką lub jagnięcą, kwasem nalidyksowym i kolistyną jest przydatna do izolowania Gardnerella vaginalis. Jest również idealny do oceny wrażliwości na antybiotyki na antybiotyki tego samego mikroorganizmu.
Ponadto stosuje się go do przygotowania agaru z krwią do hodowli beztlenowców, dodawania aminoglikozydów i wankomycyny.
Ta baza pozwala nam właściwie obserwować wzorce hemolizy.
Brucella Agar
To podłoże używane jako podstawa agaru krwionośnego wraz z dodatkiem witaminy K jest idealne do hodowli bakterii beztlenowych. W takim przypadku zaleca się stosowanie krwi jagnięcej.
Agar Campylobacter
Agar Campylobacter uzupełniony 5% krwią owczą i 5 antybiotykami (cefalotyną, amfoterycyną B, trimetoprimem, polimyksyną B i wankomycyną) jest podłożem stosowanym do izolacji Campylobacter jejuni w próbkach kału.
Przygotowanie
Każdy dom handlowy przynosi na tył pakietu instrukcje przygotowania litra pożywki hodowlanej. Odpowiednie obliczenia można wykonać w celu przygotowania pożądanej ilości, zgodnie z wybranym agarem bazowym.
Zważyć i rozpuścić
Agar bazowy jest odwodniony (proszek), więc musi być rozpuszczony w wodzie destylowanej o pH 7,3.
Ilość wskazana przez wybrany agar bazowy waży się i rozpuszcza w odpowiedniej ilości wody w fioli, następnie ogrzewa do umiarkowanego ciepła i miesza z ruchami obrotowymi, aż cały proszek się rozpuści..
Sterylizować
Po rozpuszczeniu sterylizować w autoklawie w temperaturze 121 ° C przez 20 minut.
Kruszywo krwi
Po wyjściu z autoklawu pozwól fioli ostygnąć, aż temperatura oscyluje między 40 a 50 ° C; jest temperaturą, którą wspiera ludzka skóra, a jednocześnie agar jeszcze nie zestalił się.
W tym celu fiola jest dotykana dłonią, a jeśli ciepło jest tolerowane, idealną temperaturą jest dodawanie odpowiedniej ilości rozwłóknionej krwi (50 ml na litr agaru). Delikatnie wymieszać w celu homogenizacji.
Przejście agregatu krwi ma kluczowe znaczenie, ponieważ jeśli zostanie ono wykonane, gdy podłoże jest bardzo gorące, czerwone krwinki ulegną rozbiciu i podłoże nie będzie służyło do obserwowania hemolizy.
Jeśli zostanie dodany za zimno, utworzą się grudki, a powierzchnia medium nie będzie gładka, aby odpowiednio ułożyć flet.
Wlać do szalek Petriego
Podawać w sterylnych szalkach Petriego natychmiast po homogenizacji krwi. Do każdej szalki Petriego wlewa się około 20 ml. Procedura ta jest wykonywana w kapturze z przepływem laminarnym lub w pobliżu zapalniczki.
Podczas podawania agaru z krwią na płytkach Petriego, na powierzchni płytki nie powinny pozostać pęcherzyki powietrza. Jeśli tak się stanie, płomień palnika Bunsena szybko przechodzi przez płytę, aby je wyeliminować..
Płytki pozostawia się do zestalenia i przechowuje w lodówce (2-8 ° C) odwróconej do momentu użycia. Przed użyciem płytek agarowych z krwią należy hartować (pozwolić im zająć temperaturę pokojową) do wysiewu.
Przygotowane talerze trwają około 1 tygodnia.
Referencje
- Bayona M. Warunki mikrobiologiczne do uprawy Helicobacter pylori. Rev Col Gastroenterol 2013; 28 (2): 94-99
- García P, Paredes F, Fernández del Barrio M. (1994). Praktyczna mikrobiologia kliniczna. University of Cadiz, 2. edycja. Usługa publikacji UCA.
- „Krew agarowa”. Wikipedia, darmowa encyklopedia. 10 grudnia 2018, 14:55 UTC. 27 grudnia 2018, 01: 49 en.wikipedia.org.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostyka mikrobiologiczna Bailey & Scott. 12 ed. Argentyna Panamericana S.A Editorial.
- Laboratoryjne Centrum Diagnostyki Weterynaryjnej CEDIVET. Gwatemala Dostępne pod adresem: trensa.com.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostyka mikrobiologiczna. (5 wyd.). Argentyna, redakcja Panamericana S.A..


