Struktura chemiczna tlenku manganu (MnO2), właściwości i zastosowania
The tlenek manganu (MnO2) jest nieorganicznym związkiem chemicznym utworzonym przez mangan pierwiastka o liczbie oksydacyjnej +4 i tlenu, który przy tworzeniu tlenków ma liczbę oksydacyjną -2. Znany jest również pod nazwami tlenku manganu (IV) i bezwodnika manganowego.
Jest ciałem stałym od ciemnej do czarnej kawy. Jest to w naturze mineralny pirolusyt, czarny i krystalizujący tworzący dendryty (rozgałęzione wydłużenia). Można go otrzymać jako czarną pozostałość w reakcji między nadmanganianem etylenu i potasu po utworzeniu glikolu przez utleniające działanie nadmanganianu potasu.

Jest to bardzo ważne w przemyśle szklarskim ze względu na charakter środka utleniającego, ponieważ eliminuje zielony kolor pochodzący od związków żelaznych i przekształca je w żelazo.
Indeks
- 1 Struktura chemiczna
- 2 Właściwości
- 3 zastosowania
- 3.1 Jako katalizator
- 4 Wpływ na zdrowie
- 5 referencji
Struktura chemiczna
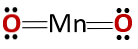
Struktura chemiczna związku odpowiada strukturze bezwodnika, a nie tlenku zasadowego, jak można by oczekiwać, ponieważ składa się z metalu i niemetalu.
Ten szczególny przypadek wynika z zachowania się manganu w różnych stanach utleniania. Zatem dla stanów utlenienia +2 i +3 tworzą tlenki MnO i Mn2O3 odpowiednio, że w reakcji z wodą tworzą odpowiednio wodorotlenek manganu i wodorotlenek manganu.
Jednak Mn2O3 w lekko kwaśnym środowisku zachowuje się jak bezwodnik. Przy stopniach utlenienia +4, +6 i +7, MnO2, MnO3 i MnO4 tworzą kwasy podczas reakcji z wodą.
W lekko kwaśnym medium MnO2 zachowuje się jak podstawowy tlenek, więc może tworzyć odpowiedni wodorotlenek.

Należy pamiętać, że w tym przypadku nie ma wzmianki o właściwościach amfoterycznych, zgodnie z którymi związek może zachowywać się jak kwas lub jako zasada. Jest to szczególny przypadek zachowania Mn.
Właściwości
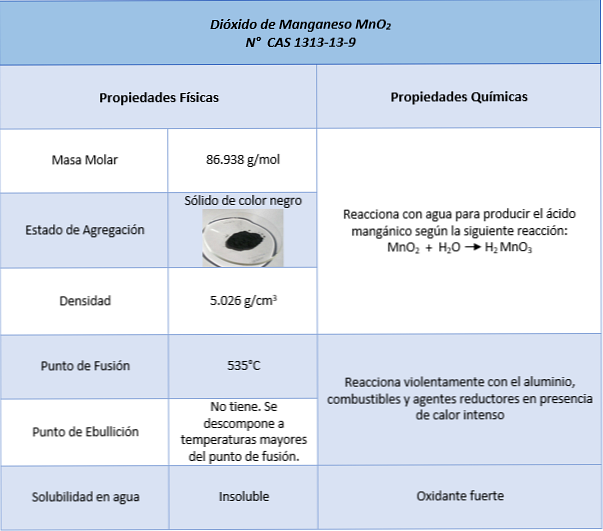
Używa
- Jest używany jako źródło manganu
- Jako utleniacz w bateriach alkalicznych
- Farby do szkła, ceramiki i porcelany.
- W uzyskiwaniu chloru i jodu.
- W rozkładzie nadtlenku wodoru do tworzenia gazowego tlenu i wody.
- W reakcji rozkładu chloranu potasu do produkcji gazowego tlenu i chlorku potasu.
- Rozpuszcza się w acetonie lub w dichlorometanie, utlenia pierwszorzędowe alkohole do aldehydów i wtórnie do ketonów.
- Produkcja baterii alkalicznych.
Jako katalizator
Dotyczy to reakcji redukcji tlenków, do usuwania siarczków, takich jak H2S i kationy jak Fe+2 i Mn+2 , arsen i radio znaleźć w wodach podziemnych, które są zanieczyszczone przez tego typu związki.
Zanieczyszczenie to może być generowane albo przez niekontrolowane wyrzucanie toksycznych materiałów, przez mycie skażonej gleby lub obecność pierwiastków chemicznych w czasie ekstrakcji wody.
MnO2 Wysoka czystość uzyskana z pirolusytu użytego jako filtr (Filox) jest najskuteczniejszym sposobem usuwania tej klasy zanieczyszczeń z wód gruntowych.
Wpływ na zdrowie
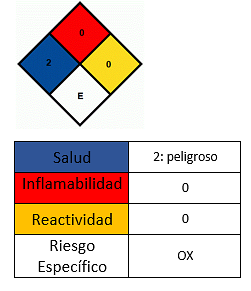
- Unikać kontaktu ze skórą.
- W przypadku kontaktu, umyj odpowiedni obszar.
- Nie wdychaj proszków.
- Podrażnienie i zaczerwienienie można zaobserwować przy kontakcie wzrokowym. Umyć dużą ilością wody, pozwolić wodzie przedostać się przez oczy i wezwać pomoc medyczną w przypadku poważnego.
- W kontakcie ze skórą obserwuje się podrażnienie i zaczerwienienie. Obfite miejsce umyć dużą ilością wody i mydła.
- Długotrwały kontakt ze skórą usuwa naturalny tłuszcz, wywołując zapalenie skóry.
- Wdychanie może spowodować stan grypopodobny (opary metali). Stan ten charakteryzuje się wysoką gorączką, dreszczami, suchością w ustach i gardle, bólami mięśni i bólami głowy.
- Może podrażniać drogi oddechowe i zwiększać częstość występowania zakażeń układu oddechowego (zapalenie płuc). Intoksykacja przez wchłanianie nieorganicznych soli manganu przez płuca jest mało prawdopodobna, ale może wystąpić przewlekłe zatrucie.
- Długotrwała ekspozycja na pył lub opary z dwutlenku manganu może wpływać na ośrodkowy układ nerwowy i prowadzić do rozwoju choroby Parkinsona, trudności z chodzeniem, skurczów mięśni i zmian w zachowaniu.
- Spożycie może powodować bóle brzucha i nudności.
- Nie jest łatwopalny, ale pomaga rozprzestrzeniać ogień w żarzących się materiałach. Po ogrzaniu do temperatury powyżej 535 ° C substancja rozkłada się na tlenek manganu (III) Mn2O3 i tlen, który jest łatwopalny i zwiększa niebezpieczeństwo pożaru. W takim przypadku ogień należy ugasić pianą lub dwutlenkiem węgla.
- W przypadku rozlania nie manipulować związkiem bez odpowiedniej ochrony osobistej.
- Przechowuj związek w szczelnie zamkniętych pojemnikach, w chłodnym i suchym miejscu, z dala od niekompatybilnych substancji, takich jak substancje organiczne i materiały palne.
- Miejsce składowania musi być suche i mieć podłogi odporne na korozję kwasową i dobrze odprowadzające wodę..
- Należy używać osobistego wyposażenia ochronnego, takiego jak rękawice, okulary ochronne, maski przeciwfiltracyjne, kurz i dym.
Referencje
- B, (2015), Dwutlenek manganu, Królewskie Towarzystwo Chemiczne - Świat chemii, odzyskany z chemistryworld.com
- Karal, (2014), Mangneso Dioxide, Safety Data Sheet, Odzyskany z, karal.com.mx
- Twój wirtualny nauczyciel (2015-02-25). Związki nieorganiczne manganu (przypadek specjalny 1) - lekcja teoretyczna), uzyskane z youtube.com
- Ecured, (s.f), Dwutlenek manganu, Odzyskany z ecured.cu
- Angarita G, Johnny., (2017), Dwutlenek manganu: wyjątkowa technologia. Hydrotec, odzyskane z hydrotecocr.com
- Fernández, G., (2015), MnO Dwutlenek manganu2/ aceton, Chemia organiczna, Odzyskany z quimicaorganica.net
- Tronox, (2011), Dwutlenek manganu, karta charakterystyki, odzyskane z, tronox.com


