Teoria morza elektronów Podstawy, właściwości i wady
The elektronowa teoria elektronów Jest to hipoteza, która wyjaśnia wyjątkowe zjawisko chemiczne, które występuje w metalowych wiązaniach między elementami o niskiej elektroujemności. Chodzi o dzielenie elektronów między różne atomy połączone wiązaniami metali.
Gęstość elektronowa między tymi ogniwami jest taka, że elektrony ulegają delokalizacji i tworzą „morze”, gdzie poruszają się swobodnie. Może to być również wyrażone przez mechanikę kwantową: niektóre elektrony (zwykle od jednego do siedmiu na atom) są rozmieszczone w orbitale z wieloma centrami rozciągniętymi na powierzchni metalu.
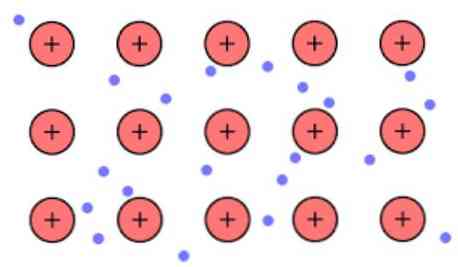
Ponadto elektrony zachowują pewne położenie w metalu, chociaż rozkład prawdopodobieństwa chmury elektronicznej ma większą gęstość wokół niektórych określonych atomów. Wynika to z faktu, że przy zastosowaniu pewnego prądu pokazują swoją przewodność w określonym kierunku.
Indeks
- 1 Podstawy teorii morza elektronów
- 2 Właściwości
- 2.1 Przesunięcie w postaci warstw
- 2.2 Teoria morza elektronów w metalicznych kryształach
- 3 Wady teorii
- 4 odniesienia
Podstawy teorii morza elektronów
Elementy metaliczne mają wielką tendencję do oddawania elektronów ze swojego ostatniego poziomu energii (warstwa walencyjna), ponieważ ich energia jonizacji jest tak niska w stosunku do innych elementów.
Wiedząc o tym, każdy element metaliczny może być uważany za kation związany z elektronem o ostatnim poziomie energii, który byłby bardziej podatny na oddanie.
Ponieważ w metalu masz dużą liczbę atomów, które są ze sobą połączone, możesz założyć, że ten metal tworzy grupę kationów metali, które są zanurzone w rodzaju morza elektronów walencyjnych o dużym offshoringu.
Biorąc pod uwagę, że siły przyciągania elektrostatycznego, które istnieją między kationem (ładunkiem dodatnim) a elektronem (ładunek ujemny) mają silnie połączone atomy metali, wyobraża sobie delokalizację elektronów walencyjnych zachowujących się jak klej elektrostatyczny, który utrzymuje wiązanie do kationów metali.
W ten sposób można wywnioskować, że im większa liczba elektronów obecnych w warstwie walencyjnej metalu, ten rodzaj kleju elektrostatycznego będzie miał większą wytrzymałość.
Właściwości
Teoria morza elektronów oferuje proste wyjaśnienie właściwości gatunków metalicznych, takich jak odporność, przewodnictwo, ciągliwość i plastyczność, które różnią się w zależności od metalu.
Odkryto, że odporność na metale wynika z dużej delokalizacji ich elektronów, która generuje bardzo dużą siłę kohezji między atomami, które ją tworzą.
W ten sposób ciągliwość jest znana jako zdolność pewnych materiałów do umożliwienia odkształcenia ich struktury, bez poddawania jej na tyle, by się zepsuły, gdy zostaną poddane pewnym siłom.
Offshoring w postaci warstw
Zarówno ciągliwość, jak i plastyczność metalu są zdeterminowane przez fakt, że elektrony walencyjne ulegają delokalizacji we wszystkich kierunkach w postaci warstw, co powoduje, że poruszają się one jedna nad drugą pod działaniem siły zewnętrznej, unika się łamania struktury metalowej, ale umożliwia jej deformację.
Podobnie, swoboda ruchu zdelokalizowanych elektronów pozwala na przepływ prądu elektrycznego, dzięki czemu metale mają bardzo dobrą przewodność elektryczną.
Ponadto to zjawisko swobodnego przepływu elektronów pozwala na transfer energii kinetycznej między różnymi obszarami metalu, co sprzyja przenoszeniu ciepła i powoduje, że metale wykazują wysoką przewodność cieplną.
Teoria morza elektronów w metalicznych kryształach
Kryształy są substancjami stałymi, które mają właściwości fizyczne i chemiczne - takie jak gęstość, temperatura topnienia i twardość - które są ustalane przez rodzaj sił, które sprawiają, że cząstki sprawiają, że pozostają razem.
W pewnym sensie uważa się, że kryształy typu metalicznego mają najprostsze struktury, ponieważ każdy „punkt” sieci krystalicznej został zajęty przez atom samego metalu.
W tym samym sensie ustalono, że ogólnie struktura kryształów metalu jest sześcienna i skupia się na twarzach lub ciele.
Jednakże gatunki te mogą mieć również kształt sześciokątny i mieć dość zwarte upakowanie, co daje im ogromną gęstość, która jest charakterystyczna.
Z tego powodu strukturalnego wiązania, które powstają w kryształach metalicznych, różnią się od tych, które występują w innych rodzajach kryształów. Elektrony, które mogą tworzyć wiązania, są delokalizowane w całej strukturze krystalicznej, jak wyjaśniono powyżej.
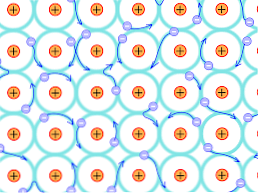
Wady teorii
W metalowych atomach jest niewielka ilość elektronów walencyjnych proporcjonalnie do ich poziomów energetycznych; to znaczy, że istnieje większa ilość dostępnych stanów energii niż ilość połączonych elektronów.
Oznacza to, że ponieważ istnieje silna delokalizacja elektroniczna, a także pasma energetyczne, które zostały częściowo wypełnione, elektrony mogą przemieszczać się przez strukturę siatkową, gdy są poddawane polu elektrycznemu pochodzącemu z zewnątrz, oprócz tworzenia oceanu elektronów to wspiera przepuszczalność sieci.
Tak więc połączenie metali jest interpretowane jako zlepek dodatnio naładowanych jonów sprzężonych przez morze elektronów (naładowane ujemnie).
Istnieją jednak cechy, które nie są wyjaśniane przez ten model, takie jak tworzenie między innymi pewnych stopów między metalami o określonych składach lub stabilność łącz metalowych..
Te wady są wyjaśnione przez mechanikę kwantową, ponieważ zarówno ta teoria, jak i wiele innych podejść, zostało ustanowionych w oparciu o najprostszy model pojedynczego elektronu, próbując zastosować znacznie bardziej złożone struktury atomów wieloelektronicznych.
Referencje
- Wikipedia. (2018). Wikipedia. Źródło z en.wikipedia.org
- Holman, J. S. i Stone, P. (2001). Chemia Pobrane z books.google.co.ve
- Parkin, G. (2010). Klejenie metal-metal. Pobrane z books.google.co.ve
- Rohrer, G. S. (2001). Struktura i wiązanie w materiałach krystalicznych. Pobrane z books.google.co.ve
- Ibach, H. i Lüth, H. (2009). Fizyka ciała stałego: wprowadzenie do zasad nauki o materiałach. Pobrane z books.google.co.ve


