Siarczek sodu Formuły, zastosowania, zagrożenia
The siarczek sodu (Na2S) jest krystaliczną substancją stałą od żółtej do czerwonej cegły. W naturze występuje w różnych stopniach uwodnienia, będąc najczęściej nonahydratem siarczku sodu (Na2S · 9H2O).
Są to rozpuszczalne w wodzie sole, które dają silnie alkaliczne roztwory. Wystawione na działanie wilgotnego powietrza pochłaniają wilgoć z powietrza, która może spontanicznie nagrzać się i spowodować zapłon pobliskich materiałów łatwopalnych. Podobnie w kontakcie z wilgotnym powietrzem emitują siarkowodór, który pachnie zgniłymi jajkami.

Są silnymi środkami redukującymi. Substancje te mogą być niebezpieczne dla środowiska, w szczególności dla organizmów wodnych.
Monosiarczek sodu jest dostępny w handlu w postaci płatków zawierających 60-62% Na2S ...
- Wzory

- CAS: 1313-82-2 Siarczek sodu (bezwodny)
- CAS: 1313-84-4 Siarczek sodu (niehydratowany)
Struktura 2D
Struktura 3D
Charakterystyka siarczku sodu
Właściwości fizyczne i chemiczne

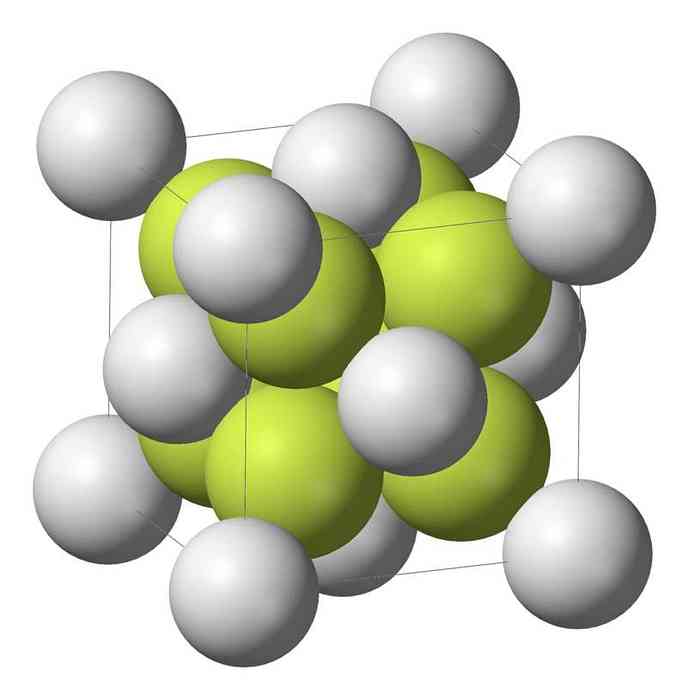
Monosiarczek sodu (Na2S) krystalizuje ze strukturą antyfluorową, w której każdy atom S jest otoczony sześcianem 8 atomów Na i każdy atom Na przez czworościan 4 atomów S..
Palność
Jedynym wysoce łatwopalnym członkiem w grupie nieorganicznych siarczków jest siarkowodór. Jednak niektóre inne nieorganiczne siarczki, takie jak siarczek sodu, mogą samorzutnie się nagrzać, a nawet zapalić pod wpływem wilgoci..
Pod wpływem ognia siarczek sodu wydziela gazy lub pary dwutlenku siarki, które są drażniące lub toksyczne.
Reaktywność
- Siarczki nieorganiczne są na ogół zasadowe (niektóre są silnie zasadowe, a zatem niekompatybilne z kwasami).
- Wiele z tych związków jest reduktorami (reagują energicznie z czynnikami utleniającymi).
- Proste sole siarczków (takie jak siarczek sodu, potasu i amonu) reagują energicznie z kwasami, uwalniając wysoce toksyczny i łatwopalny gazowy siarkowodór.
- Siarczek sodu jest łatwopalny. Może wybuchnąć, gdy zostanie szybko podgrzany lub uderzony.
- Po podgrzaniu do rozkładu wydziela toksyczne opary tlenku sodu i tlenków siarki.
- Gwałtownie (W) wchodzi w reakcję z węglem, węglem drzewnym, solami diazoniowymi, N, N-dichlorometyloaminą, silnymi utleniaczami i wodą.
Toksyczność
Wielu członków grupy nieorganicznych siarczków zachowuje się jak mocne zasady i może powodować poważne oparzenia, gdy wejdą w kontakt ze skórą.
Ta właściwość zależy od jego rozpuszczalności. Najbardziej nierozpuszczalne nieorganiczne siarczki (na przykład siarczek rtęci (II) i siarczek kadmu) nie są żrące.
Siarczek sodu ma współczynnik podziału oktanol / woda (Pow) (-3,5). Ta wartość jest stosowana jako miara rozpuszczalności (i biokoncentracji) substancji w zwierzęcych tkankach tłuszczowych (zwłaszcza zwierząt wodnych).
Siarczek sodu jest uważany za niebezpieczny dla środowiska, zwłaszcza dla organizmów wodnych.
Używa
W domu siarczek sodu jest używany do odkrywania rur, domowych środków czyszczących (do pieca, łazienki), prostownic do włosów, mydła do naczyń i automatycznych poduszek powietrznych.
W przemyśle stosuje się go w środkach czyszczących, w cemencie i jako prekursor w produkcji innych produktów chemicznych.
Efekty kliniczne
Narażenie na siarczek sodu jest powszechne w krajach rozwiniętych i krajach słabo rozwiniętych, zarówno w przemyśle, jak iw domu. Te żrące substancje występują w kilku produktach gospodarstwa domowego w niskim stężeniu.
W krajach rozwiniętych poważne skutki są rzadkie. Występują one głównie z powodu celowego spożycia substancji chemicznej u dorosłych. Jednak w krajach rozwijających się poważne skutki są bardziej powszechne.
Alkaliczne substancje żrące powodują martwicę z powodu upłynnienia. Zmydlaj tłuszcze w błonie komórkowej, niszcząc komórkę i pozwalając na głęboką penetrację do tkanek błon śluzowych.
Narażenie doustne
Początkowe zapalenie występuje w tkance żołądkowo-jelitowej, po której następuje martwica tkanek (z możliwą perforacją), następnie granulacja i ostatecznie tworzenie zwężenia.
U pacjentów z łagodnym spożyciem rozwija się podrażnienie lub oparzenia stopnia I (powierzchowne przekrwienie i obrzęk) ustnej części gardła, przełyku lub żołądka.
U pacjentów z umiarkowanym zatruciem mogą wystąpić oparzenia stopnia II (powierzchowne pęcherze, nadżerki i owrzodzenia) z możliwym dalszym powstawaniem zwężenia (szczególnie przełyku).
U niektórych pacjentów (zwłaszcza małych dzieci) może wystąpić obrzęk górnych dróg oddechowych.
Pacjenci z ciężkim zatruciem po spożyciu mogą rozwinąć głębokie oparzenia i martwicę błony śluzowej przewodu pokarmowego, z powikłaniami takimi jak: perforacja (przełyk, żołądek, rzadko dwunastnica), tworzenie przetoki (tchawiczo-przełykowy, aortalno-przełykowy) i krwotok z przewodu pokarmowego.
Mogą rozwinąć się: niedociśnienie, tachykardia, tachypnea, tworzenie zwężenia (głównie przełyku), rak przełyku i obrzęk górnych dróg oddechowych (co jest częste i często zagrażające życiu).
Ciężkie zatrucie jest na ogół ograniczone do celowego przyjmowania u dorosłych.
Narażenie przez wdychanie
Łagodne narażenie może powodować kaszel i skurcz oskrzeli.
Ciężkie wdychanie może powodować obrzęk górnych dróg oddechowych, oparzenia, stridor i rzadko ostre uszkodzenie płuc.
Narażenie oczu
Może powodować ciężkie podrażnienie spojówek i chemozę, wady nabłonka rogówki, niedokrwienie limbiczne, trwałą utratę wzroku oraz w ciężkich przypadkach perforacji..
Narażenie przez skórę
Łagodne narażenie powoduje podrażnienia i oparzenia o częściowej grubości. Kwasica metaboliczna może rozwinąć się u pacjentów z ciężkimi oparzeniami lub wstrząsem.
Długotrwałe narażenie lub produkty o wysokim stężeniu mogą powodować oparzenia całkowitej grubości.
Bezpieczeństwo i ryzyko
Oświadczenia o zagrożeniach globalnie zharmonizowanego systemu klasyfikacji i oznakowania chemikaliów (SGA)
Globalnie Zharmonizowany System Klasyfikacji i Oznakowania Chemikaliów (SGA) jest systemem uzgodnionym na szczeblu międzynarodowym, stworzonym przez Organizację Narodów Zjednoczonych i mającym na celu zastąpienie różnych standardów klasyfikacji i oznakowania stosowanych w różnych krajach przy użyciu spójnych kryteriów na całym świecie.
Klasy zagrożeń (i odpowiadający im rozdział GHS), normy klasyfikacji i oznakowania oraz zalecenia dotyczące siarczku sodu są następujące (Europejska Agencja Chemikaliów, 2017, Organizacja Narodów Zjednoczonych, 2015, PubChem, 2017):







Referencje
- Benjah-bmm27, (2006). Fluoryt-jednostka-komórka-3D-jon [Źródło] Źródło: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [image] Źródło: chem.nlm.nih.gov.
- ChemIDplus, (2017). Struktura 3D 1313-82-2 - Siarczek sodu [image] Źródło: chem.nlm.nih.gov.
- ChemIDplus, (2017). Struktura 3D 1313-84-4 - Siarczek sodu [image] Źródło: chem.nlm.nih.gov.
- Europejska Agencja Chemikaliów (ECHA). (2017). Podsumowanie klasyfikacji i oznakowania.
- Klasyfikacja zharmonizowana - załącznik VI do rozporządzenia (WE) nr 1272/2008 (rozporządzenie CLP). Siarczek sodu. Pobrane 16 stycznia 2017 r. Z: echa.europa.eu.
- Europejska Agencja Chemikaliów (ECHA). (2017). Podsumowanie klasyfikacji i oznakowania.
- Zgłoszona klasyfikacja i oznakowanie. Siarczek sodu, uwodniony. Pobrane 16 stycznia 2017 r. Z: echa.europa.eu.
- Bank danych substancji niebezpiecznych (HSDB). TOXNET (2017). Siarczek sodu. Bethesda, MD, EU: National Library of Medicine. Źródło: toksnet.nlm.nih.gov.
- Lange, L. i Triebel, W. (2000). Siarczki, polisiarczki i sulfany. W Encyklopedii chemii przemysłowej Ullmanna. Wiley-VCH Verlag GmbH & Co. KGaA. Źródło z dx.doi.org.
- Organizacja Narodów Zjednoczonych (2015). Globalnie Zharmonizowany System Klasyfikacji i Oznakowania Produktów Chemicznych (SGA) Szósta edycja poprawiona. Nowy Jork, Stany Zjednoczone: publikacja ONZ. Źródło: unece.org.
- National Center for Biotechnology Information. Baza danych PubChem. (2016). Enneahydrat siarczku sodu - PubChem Structure [image] Źródło: pubchem.ncbi.nlm.nih.gov.
- National Center for Biotechnology Information. Baza danych PubChem. (2017). Monosiarczek sodu. Bethesda, MD, EU: National Library of Medicine. Źródło: pubchem.ncbi.nlm.nih.gov.
- National Center for Biotechnology Information. Baza danych PubChem. (2017). Enneahydrat siarczku sodu. Bethesda, MD, EU: National Library of Medicine. Źródło: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Arkusz danych chemicznych. Siarczek sodu, bezwodny. Silver Spring, MD. UE; Źródło: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Reaktywny arkusz danych grupy. Siarczki, nieorganiczne. Silver Spring, MD. UE; Źródło: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Źródło: wikipedia.org.
- PubChem, (2016). Monosiarczek sodu [zdjęcie] Źródło: puchem.nlm.nih.gov.
- PubChem, (2016). Sodium Sulfide enneahydrate [image] Źródło: puchem.nlm.nih.gov.
- Wikipedia. (2017). Współczynnik podziału oktanol-woda. Źródło: 17 stycznia 2017 r. Z: wikipedia.org.
- Wikipedia. (2017). Siarczek sodu. Źródło: 17 stycznia 2017 r. Z: wikipedia.org.


