Sole organiczne właściwości fizyczne i chemiczne, zastosowania i przykłady
The sole organiczne są gęstą liczbą związków jonowych o niezliczonych właściwościach. Pochodzą one wcześniej ze związku organicznego, który przeszedł transformację, która pozwala mu być nośnikiem ładunku, a także jego tożsamość chemiczna zależy od powiązanego jonu.
Na poniższym zdjęciu pokazano dwa bardzo ogólne wzory chemiczne soli organicznych. Pierwszy z nich, R-AX, jest interpretowany jako związek, w którego strukturze węgla atom lub grupa A niesie dodatni ładunek + lub ujemny (-).
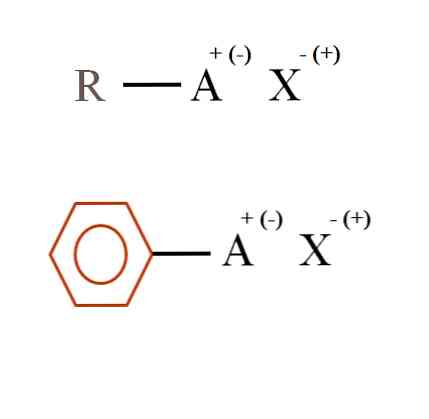
Jak widać, istnieje wiązanie kowalencyjne między R i A, R-A, ale z kolei A ma ładunek formalny, który przyciąga (lub odpycha) jon X. Znak ładunku będzie zależał od charakteru A i środowiska chemicznego.
Jeśli A byłaby pozytywna, ile X może z nią współdziałać? Tylko jeden, biorąc pod uwagę zasadę elektroobojętności (+ 1-1 = 0). Jaka jest jednak tożsamość X? Anion X może być CO32-, wymagające dwóch kationów RA+; halogenek: F-, Cl-, Br-, itd.; lub nawet inny związek RA-. Opcje są nieobliczalne.
Ponadto sól organiczna może mieć charakter aromatyczny, przedstawiony w brązowym pierścieniu benzenowym. Sól benzoesanu miedzi (II), (C6H5COO)2Cu, na przykład, składa się z dwóch pierścieni aromatycznych z ujemnie naładowanymi grupami karboksylowymi, które oddziałują z kationem Cu.2+.
Indeks
- 1 Właściwości fizyczne i chemiczne
- 1.1 Wysokie masy cząsteczkowe
- 1.2 Amfifile i środki powierzchniowo czynne
- 1.3. Wysokie temperatury wrzenia lub topnienia
- 1.4 Kwasowość i zasadowość
- 2 zastosowania
- 3 Przykłady soli organicznych
- 3.1 Karboksylany
- 3.2 Diakrylupracje litu
- 3.3 Sole sulfoniowe
- 3.4 Sole oksoniowe
- 3.5 Sole aminowe
- 3.6 Sole diazoniowe
- 4 odniesienia
Właściwości fizyczne i chemiczne
Na podstawie obrazu można stwierdzić, że sole organiczne składają się z trzech składników: organicznego, R lub Ar (pierścień aromatyczny), atomu lub grupy zawierającej ładunek jonowy A i przeciwjonu X.
Tak jak tożsamość i struktura chemiczna są zdefiniowane przez takie składniki, tak ich właściwości zależą od nich.
Z tego faktu można podsumować pewne ogólne właściwości, które spełniają ogromną większość tych soli.
Wysokie masy cząsteczkowe
Zakładając mono lub poliwalentne nieorganiczne aniony X, sole organiczne zwykle mają znacznie większe masy cząsteczkowe niż sole nieorganiczne. Wynika to głównie ze szkieletu węglowego, którego proste wiązania C-C i ich atomy wodoru przyczyniają się do dużej masy związku.
Dlatego są one R lub Ar odpowiedzialne za ich wysokie masy cząsteczkowe.
Amfifile i środki powierzchniowo czynne
Sole organiczne są związkami amfifilowymi, to znaczy ich struktury mają zarówno hydrofilowe, jak i hydrofobowe końce.
Jakie są takie skrajności? R lub Ar reprezentują hydrofobowy koniec, ponieważ ich atomy C i H nie mają dużego powinowactwa do cząsteczek wody.
A+(-), atom lub grupa niosąca ładunek, jest hydrofilowym końcem, ponieważ przyczynia się do momentu dipolarnego i oddziałuje z dipolami tworzącymi wodę (RA+ OH2).
Gdy regiony hydrofilowe i hydrofobowe są spolaryzowane, sól amfifilowa staje się środkiem powierzchniowo czynnym, substancją szeroko stosowaną do wytwarzania detergentów i demulgatory.
Wysokie temperatury wrzenia lub topnienia
Podobnie jak sole nieorganiczne, sole organiczne mają również wysokie temperatury topnienia i wrzenia ze względu na siły elektrostatyczne, które regulują fazę ciekłą lub stałą.
Jednak posiadając organiczny składnik R lub Ar, inne rodzaje sił Van der Waalsa (siły Londynu, dipol-dipol, mostki wodorowe) konkurują w pewien sposób z elektrostatycznym.
Z tego powodu stałe lub ciekłe struktury soli organicznych są w pierwszym rzędzie bardziej złożone i zróżnicowane. Niektóre z nich mogą nawet zachowywać się jak ciekłe kryształy.
Kwasowość i zasadowość
Sole organiczne są zwykle mocniejszymi kwasami lub zasadami niż sole nieorganiczne. Dzieje się tak dlatego, że A, na przykład w solach aminowych, ma ładunek dodatni ze względu na jego wiązanie z dodatkowym wodorem: A+-H. Następnie w kontakcie z bazą podaruj proton, aby powrócić do neutralnego związku:
RA+H + B => RA + HB
H należy do A, ale jest napisane, ponieważ ingeruje w reakcję neutralizacji.
Z drugiej strony RA+ może to być duża cząsteczka, niezdolna do tworzenia ciał stałych z krystaliczną siecią wystarczająco stabilną z anionem hydroksylowym lub hydroksylem OH-.
W takim przypadku sól RA+OH- zachowuje się jak mocna podstawa; nawet tak podstawowe jak NaOH lub KOH:
RA+OH- + HCl => RACl + H2O
Zauważ w równaniu chemicznym, że anion Cl- zastępuje OH-, tworzenie soli RA+Cl-.
Używa
Stosowanie soli organicznych będzie się różnić w zależności od tożsamości R, Ar, A i X. Ponadto zastosowanie, do którego są przeznaczone, zależy również od rodzaju ciała stałego lub cieczy, które tworzą. Niektóre ogólne informacje w tym zakresie to:
-Służą jako odczynniki do syntezy innych związków organicznych. RAX może działać jako „dawca” łańcucha R dodawanego do innego związku zastępującego dobrą odchodzącą grupę.
-Są to środki powierzchniowo czynne, więc mogą być również stosowane jako smary. W tym celu stosuje się sole metali karboksylanów.
-Pozwalają na syntezę szerokiej gamy barwników.
Przykłady soli organicznych
Karboksylany
Kwasy karboksylowe reagują z wodorotlenkiem w reakcji neutralizacji, powodując powstanie soli karboksylanów: RCOO- M+; gdzie M+ Może to być dowolny kation metalu (Na+, Pb2+, K+, itp.) lub kation amonowy NH4+.
Kwasy tłuszczowe są długołańcuchowymi alifatycznymi kwasami karboksylowymi, mogą być nasycone i nienasycone. Kwas palmitynowy (CH) jest jednym z nasyconych3(CH2)14COOH). Pochodzi z soli palmitynianowej, podczas gdy kwas stearynowy (CH3(CH2)16COOH tworzy sól stearynianową. Mydła składają się z tych soli.
W przypadku kwasu benzoesowego, C6H5COOH (gdzie C6H5- jest to pierścień benzenowy), gdy reaguje z zasadą tworzy sole benzoesanowe. We wszystkich karboksylanach grupa -COO- reprezentuje A (RAX).
Diakupupraty litowe
Diakupian litu jest przydatny w syntezie organicznej. Jego wzór to [R-Cu-R]-Li+, w którym atom miedzi niesie ładunek ujemny. W tym przypadku miedź reprezentuje atom A obrazu.
Sole sulfoniowe
Powstają w wyniku reakcji siarczku organicznego z halogenkiem alkilu:
R2S + R'X => R2R'S+X
W przypadku tych soli atom siarki ma dodatni ładunek formalny (S+) posiadające trzy wiązania kowalencyjne.
Sole oksoniowe
Również etery (utlenione analogi siarczków) reagują z hydrocydami, tworząc sole oksoniowe:
ROR '+ HBr <=> RO+HR '+ Br-
Kwasowy proton HBr jest kowalencyjnie związany z atomem tlenu eteru (R2O+-H), ładowanie go pozytywnie.
Sole aminowe
Aminy mogą być pierwszorzędowe, drugorzędowe, trzeciorzędowe lub czwartorzędowe, a także ich sole. Wszystkie z nich charakteryzują się tym, że mają atom H związany z atomem azotu.
Więc, RNH3+X- jest to sól pierwszorzędowej aminy; R2NH2+X-, aminy drugorzędowej; R3NH+X-, trzeciorzędowej aminy; i R4N+X-, czwartorzędowej aminy (czwartorzędowa sól amoniowa).
Sole diazoniowe
Wreszcie sole diazoniowe (RN2+X-) lub arildiazonium (ArN)2+X-), stanowią punkt wyjścia dla wielu związków organicznych, zwłaszcza barwników azowych.
Referencje
- Francis A. Carey. Chemia organiczna (Wydanie szóste., Str. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Chemia organiczna. Aminy (10. edycja.). Wiley Plus.
- Wikipedia. (2018). Sól (chemia). Zrobiono z: en.wikipedia.org
- Steven A. Hardinger. (2017). Ilustrowany słownik chemii organicznej: sole. Źródło: chem.ucla.edu
- Chevron Oronite. (2011). Karboksylany. [PDF] Źródło: oronite.com


