Prawo Raoulta, na czym polega, pozytywne i negatywne odchylenia
The Prawo Raoulta został zaproponowany przez francuskiego chemika François-Marie Raoulta w 1887 roku i służy do wyjaśnienia zachowania ciśnienia pary roztworu dwóch mieszalnych substancji (zazwyczaj idealnych) w zależności od częściowej prężności pary każdego składnika obecnego w tym.
Istnieją prawa chemii, które są używane do opisania zachowania substancji w różnych warunkach i wyjaśnienia zjawisk, w których są one zaangażowane, przy użyciu naukowo sprawdzonych modeli matematycznych. Prawo Raoulta jest jednym z nich.

Korzystając z wyjaśnienia opartego na interakcjach między cząsteczkami gazów (lub cieczy) w celu przewidywania zachowania ciśnienia pary, prawo to jest wykorzystywane do badania rozwiązań nieidealnych lub rzeczywistych, pod warunkiem, że konieczne współczynniki zostaną uwzględnione w celu skorygowania modelu matematyczny i dostosuj go do warunków nieidealnych.
Indeks
- 1 Z czego się składa??
- 2 Pozytywne i negatywne odchylenia
- 2.1 Pozytywne odchylenia
- 2.2 Odchylenia ujemne
- 3 Przykłady
- 3.1 Mieszanina podstawowa
- 3.2 Mieszanina binarna z nielotną substancją rozpuszczoną
- 4 odniesienia
Z czego to się składa??
Prawo Raoulta opiera się na założeniu, że zastosowane rozwiązania zachowują się w idealny sposób: dzieje się tak, ponieważ prawo to opiera się na założeniu, że siły międzycząsteczkowe między różnymi cząsteczkami są takie same jak między podobnymi cząsteczkami (które to nie jest tak skuteczne w rzeczywistości).
W rzeczywistości im bliżej ideału jest rozwiązanie, tym więcej możliwości będzie musiało spełniać cechy proponowane przez to prawo..
Prawo to wiąże ciśnienie pary roztworu z nielotną substancją rozpuszczoną, stwierdzając, że będzie ono równe prężności pary tej czystej substancji rozpuszczonej w tej temperaturze, pomnożone przez jej ułamek molowy. Jest to wyrażone w kategoriach matematycznych dla pojedynczego składnika w następujący sposób:
Pi = Pºi . Xi
W tym wyrażeniu Pi jest równe częściowemu ciśnieniu pary składnika i w mieszaninie gazów, Pºi to ciśnienie pary czystego składnika i oraz Xi jest ułamkiem molowym składnika i w mieszaninie.
W ten sam sposób, gdy masz kilka składników w rozwiązaniu i osiągnęły stan równowagi, możesz obliczyć całkowitą prężność pary roztworu przez połączenie prawa Raoulta z Daltonem:
P = PºAXA + PºBXB + PºCXc...
Również w tych rozwiązaniach, w których występuje tylko jedna substancja rozpuszczona i rozpuszczalnik, prawo można sformułować w sposób przedstawiony poniżej:
PA = (1-XB) x PºA
Pozytywne i negatywne odchylenia
Rozwiązania, które można badać za pomocą tego prawa, powinny normalnie zachowywać się idealnie, ponieważ interakcje między ich cząsteczkami są małe i pozwalają na przyjęcie tych samych właściwości w całym rozwiązaniu bez wyjątku..
Jednak idealne rozwiązania są praktycznie nieistniejące, więc dwa współczynniki muszą być włączone do obliczeń reprezentujących oddziaływania międzycząsteczkowe. Są to współczynnik fugacity i współczynnik aktywności.
W tym sensie odchylenia w odniesieniu do prawa Raoulta są definiowane jako pozytywne lub negatywne, w zależności od wyników uzyskanych w tym czasie.
Pozytywne odchylenia
Pozytywne odchylenia w odniesieniu do prawa Raoulta pojawiają się, gdy ciśnienie pary roztworu jest większe niż obliczone zgodnie z prawem Raoulta.
Dzieje się tak, gdy siły kohezji między podobnymi cząsteczkami są większe niż te same siły między różnymi cząsteczkami. W tym przypadku oba składniki łatwiej odparowują.
To odchylenie jest widoczne na krzywej ciśnienia pary jako maksymalny punkt w określonej kompozycji, tworząc pozytywny azeotrop.
Azeotrop jest ciekłą mieszaniną dwóch lub więcej związków chemicznych, która zachowuje się, jakby była utworzona przez pojedynczy składnik i która odparowuje bez zmiany składu.
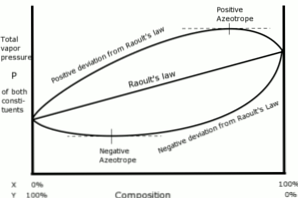
Negatywne odchylenia
Ujemne odchylenia od prawa Raoulta występują, gdy ciśnienie pary mieszaniny jest niższe niż oczekiwane po obliczeniu zgodnie z prawem.
Te odchylenia pojawiają się, gdy siły kohezji między cząsteczkami mieszaniny są większe niż średnia sił między cząstkami cieczy w ich czystym stanie.
Ten rodzaj odchylenia generuje zatrzymanie każdego składnika w jego stanie ciekłym przez siły przyciągania większe niż siły substancji w stanie czystym, tak że częściowa prężność pary w systemie jest zmniejszona.
Negatywne azeotropy na krzywych ciśnienia pary reprezentują minimalny punkt i wykazują powinowactwo między dwoma lub większą liczbą składników zaangażowanych w mieszaninę.
Przykłady
Prawo Raoulta jest powszechnie stosowane do obliczania ciśnienia rozwiązania na podstawie jego sił międzycząsteczkowych, porównując obliczone wartości z wartościami rzeczywistymi, aby stwierdzić, czy istnieje jakiekolwiek odchylenie i czy powinno to być dodatnie czy ujemne. Poniżej znajdują się dwa przykłady użycia prawa Raoulta:
Mieszanka podstawowa
Następująca mieszanina, składająca się z propanu i butanu, stanowi przybliżenie prężności pary i możemy założyć, że oba składniki są w niej w równych proporcjach (50-50), w temperaturze 40 ° C:
Xpropan = 0,5
Pºpropan = 1352,1 kPa
Xbutan = 0,5
Pºbutan = 377,6 kPa
Jest obliczany zgodnie z prawem Raoulta:
Pmieszanka = (0,5 x 377,6 kPa) + (0,5 x 1422,1 kPa)
Więc:
Pmieszanka = 864,8 kPa
Mieszanina binarna z nielotną substancją rozpuszczoną
Czasami zdarza się, że substancja rozpuszczona w mieszaninie jest nielotna, więc prawo jest używane do zrozumienia zachowania ciśnienia pary.
Podano mieszaninę wody i cukru w proporcjach odpowiednio 95% i 5%, aw normalnych warunkach temperaturowych:
Xwoda = 0,95
Pºwoda = 2,34 kPa
Xcukier = 0,05
Pºcukier = 0 kPa
Jest obliczany zgodnie z prawem Raoulta:
Pmieszanka = (0,95 x 2,34 kPa) + (0,05 x 0 kPa)
Więc:
Pmieszanka = 2,22 kPa
Najwyraźniej nastąpiło obniżenie ciśnienia pary wodnej z powodu oddziaływania sił międzycząsteczkowych.
Referencje
- Anne Marie Helmenstine, P. (s.f.). Definicja prawa Raoulta. Pobrane z thinkco.com
- ChemGuide. (s.f.). Prawo Raoulta i nielotne substancje rozpuszczone. Pobrane z chemguide.co.uk
- LibreTexts. (s.f.). Prawo Raoulta i idealne mieszanki cieczy. Źródło: chem.libretexts.org
- Neutrium. (s.f.). Prawo Raoulta. Pobrane z neutrium.net
- Wikipedia. (s.f.). Prawo Raoulta. Źródło z en.wikipedia.org


