Właściwości chlorku cyny (SnCl2), struktura, zastosowania i zagrożenia
The chlorek cyny (II) lub chlorek cynawy o wzorze chemicznym SnCl2, jest białym krystalicznym związkiem stałym, produktem reakcji cyny i stężonego roztworu kwasu chlorowodorowego: Sn (s) + 2HCl (conc) => SnCl2(aq) + H2(g) Proces jego syntezy (przygotowania) polega na dodawaniu kawałków opiłków cyny do reakcji z kwasem.
Po dodaniu kawałków cyny przechodzi do dehydratacji i krystalizacji, aż do uzyskania soli nieorganicznej. W tym związku cyna straciła dwa elektrony ze swojej powłoki walencyjnej, tworząc wiązania z atomami chloru.
Można to lepiej zrozumieć, jeśli weźmie się pod uwagę konfigurację walencyjną cyny (5s25px2stri0strz0), z których para elektronów zajmuje orbitę px jest podana protonom H+, w celu utworzenia dwuatomowej cząsteczki wodoru. Oznacza to, że jest to reakcja typu redoks.
Indeks
- 1 Właściwości fizyczne i chemiczne
- 1.1 Konfiguracja Walencji
- 1.2 Reaktywność
- 1.3 Aktywność redukcyjna
- 2 Struktura chemiczna
- 3 zastosowania
- 4 Zagrożenia
- 5 referencji
Właściwości fizyczne i chemiczne
Łącza SnCl2 Czy są jonowe czy kowalencyjne? Właściwości fizyczne chlorku cyny (II) wykluczają pierwszą opcję. Temperatura topnienia i wrzenia tego związku wynosi 247 ° C i 623 ° C, co wskazuje na słabe oddziaływania międzycząsteczkowe, wspólny fakt dla związków kowalencyjnych.
Jego kryształy są białe, co przekłada się na zerową absorpcję w widmie widzialnym.
Konfiguracja w Walencji
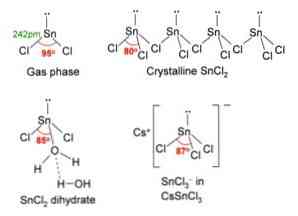
Na powyższym obrazku w lewym górnym rogu zilustrowano wyizolowaną cząsteczkę SnCl2.
Geometria cząsteczkowa powinna być płaska, ponieważ hybrydyzacja centralnego atomu to sp2 (3 orbital sp2 i czysty orbital p tworzący wiązania kowalencyjne), ale wolna para elektronów zajmuje objętość i wypycha atomy chloru w dół, dając cząsteczce geometrię kątową.
W fazie gazowej związek ten jest izolowany, więc nie oddziałuje z innymi cząsteczkami.
Jako strata pary elektronów w orbicie px, cyna jest przekształcana w jon Sn2+ a jego wynikowa konfiguracja elektroniczna to 5s25px0stri0strz0, z wszystkimi jego orbitaliami p dostępnymi do akceptowania linków z innych gatunków.
Jony Cl- koordynować z jonami Sn2+ dać chlorek cyny. Elektroniczna konfiguracja cyny w tej soli to 5s25px2stri2strz0, możliwość przyjęcia innej pary elektronów w swoim wolnym orbicie pz.
Na przykład możesz zaakceptować inny jon Cl-, tworząc kompleks geometrii płaszczyzny trygonalnej (piramida o podstawie trójkątnej) i naładowany ujemnie [SnCl3]-.
Reaktywność
SnCl2 ma wysoką reaktywność i tendencję do zachowywania się jak kwas Lewisa (receptor elektronowy) w celu uzupełnienia oktetu wartościowości.
Tak jak akceptuje jon Cl-, to samo dzieje się z wodą, która „uwadnia” atom cyny, łącząc cząsteczkę wody bezpośrednio z cyną, a druga cząsteczka wody tworzy interakcje wiązania wodorowego z pierwszą.
Wynikiem tego jest SnCl2 nie jest czysty, ale skoordynowany z wodą w jego dihydratowanej soli: SnCl2· 2H2O.
SnCl2 Jest bardzo dobrze rozpuszczalny w wodzie i rozpuszczalnikach polarnych, ponieważ jest związkiem polarnym. Jednak jego rozpuszczalność w wodzie, mniejsza niż masa masy, aktywuje reakcję hydrolizy (zerwanie cząsteczki wody) w celu wytworzenia zasadowej i nierozpuszczalnej soli:
SnCl2(aq) + H2O (l) <=> Sn (OH) Cl (s) + HCl (aq)
Podwójna strzałka wskazuje, że ustalono równowagę, faworyzowaną w lewo (w kierunku reagentów), jeśli stężenie HCl wzrasta. W tym celu rozwiązania SnCl2 stosowane mają kwaśne pH, aby uniknąć wytrącania niepożądanego produktu hydrolizy soli.
Aktywność redukcyjna
Reaguje z tlenem w powietrzu, tworząc chlorek cyny (IV) lub chlorek cynowy:
6 SnCl2(aq) + O2(g) + 2H2O (1) => 2SnCl4(aq) + 4Sn (OH) Cl (s)
W tej reakcji cyna utlenia się tworząc wiązanie z elektroujemnym atomem tlenu i zwiększa liczbę wiązań z atomami chloru.
Ogólnie rzecz biorąc, elektroujemne atomy halogenów (F, Cl, Br i I) stabilizują wiązania związków Sn (IV) i ten fakt wyjaśnia, dlaczego SnCl2 jest środkiem redukującym.
Gdy utlenia się i traci wszystkie swoje elektrony walencyjne, jon Sn4+ pozostaje w konfiguracji 5s05px0stri0strz0, jako para elektronów w orbicie 5s najtrudniejsza do „porwania”.
Struktura chemiczna
SnCl2 przedstawia strukturę krystaliczną typu rombowego, podobną do rzędów pił, w których wierzchołkami zębów są chlorki.
Każdy rząd jest łańcuchem SnCl3 tworzenie mostka Cl z innym atomem Sn (Cl-Sn (Cl)2-Cl- ···, jak widać na obrazku powyżej. Dwa łańcuchy połączone słabymi oddziaływaniami typu Sn-Cl stanowią jedną warstwę układu, która nakłada się na inną warstwę i tak dalej, aż krystaliczne ciało stałe zostanie zdefiniowane.
Para wolnych elektronów 5s2 powoduje zniekształcenie struktury, ponieważ zajmuje objętość (objętość chmury elektronicznej).
Sn może mieć liczbę koordynacyjną równą dziewięć, która jest taka sama jak posiadanie dziewięciu sąsiadów, rysujących pryzmat trygonalny z tym położonym w środku figury geometrycznej i Cl w wierzchołkach, oprócz innych Cl znajdujących się w każdym kwadratowych powierzchni pryzmatu.
Łatwiej jest to zaobserwować, jeśli weźmiemy pod uwagę łańcuch, w którym Sn (ciemnoszare kule) są skierowane w górę, a trzy Cl połączone z nim tworzą trójkątną podłogę, podczas gdy trzy górne Cls tworzą trójkątny dach.
Używa
W syntezie organicznej stosuje się go jako środek redukujący aromatyczne związki nitrowe (Ar-NO2 à Ar-NH2). Ponieważ jego struktura chemiczna jest laminarna, znajduje zastosowanie w świecie katalizy reakcji organicznych, oprócz tego, że jest potencjalnym kandydatem do wsparcia katalitycznego.
Jego właściwość redukująca jest używana do określenia obecności związków złota, do powlekania szkieł srebrnymi zwierciadłami i do działania jako przeciwutleniacz.
Również w piramidzie trygonalnej o geometrii molekularnej (: SnX3- M+) jest stosowany jako zasada Lewisa do syntezy dużej liczby związków (takich jak kompleks klastrów Pt)3Sn8Cl20, gdzie para bez elektronów jest skoordynowana z kwasem Lewisa).
Ryzyko
SnCl2 Może uszkodzić białe krwinki. Jest żrący, drażniący, rakotwórczy i ma duży negatywny wpływ na gatunki zamieszkujące ekosystemy morskie.
Może się rozkładać w wysokich temperaturach, uwalniając szkodliwy gazowy chlor. W kontakcie z silnie utleniającymi czynnikami wywołuje reakcje wybuchowe.
Referencje
- Shiver i Atkins. (2008). Chemia nieorganiczna W Elementy grupy 14 (czwarte wydanie., strona 329). Mc Graw Hill.
- ChemicalBook. (2017). Pobrane 21 marca 2018 r. Z ChemicalBook: chemicalbook.com
- PubChem. (2018). Chlorek cyny. Pobrane 21 marca 2018 r. Z PubChem: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2017). Chlorek cyny (II). Pobrane 21 marca 2018 r. Z Wikipedii: en.wikipedia.org
- E. G. Rochow, E. W. (1975). Chemia germanu: cyna i ołów (pierwsze wydanie). p-82,83. Pergamom Press.
- F. Hulliger. (1976). Chemia strukturalna faz typu warstwowego. P-120,121. D. Reidel Publishing Company.



