Formuła kwasu propanowego, właściwości, zagrożenia i zastosowania
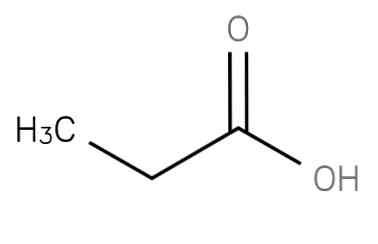
The kwas propanowy oznacza nasycony krótkołańcuchowy kwas tłuszczowy zawierający etan przyłączony do węgla grupy karboksylowej. Jego formuła to CH3-CH2-Anion CH3CH2COO- jak również sole i estry kwasu propanowego są znane jako propioniany (lub propanoany).
Można go uzyskać z odpadowej pulpy drzewnej w procesie fermentacji z użyciem bakterii z rodzaju propionibacterium. Otrzymuje się go również z etanolu i tlenku węgla, stosując katalizator trifluorku boru (O'Neil, 2001).
Innym sposobem uzyskania kwasu propanowego jest utlenianie aldehydu propionowego w obecności jonów kobaltu lub manganu. Ta reakcja rozwija się szybko w temperaturach tak niskich, jak 40-50 ° C:
2CH3CH2CHO + O2 → 2CH3CH2COOH
Związek jest naturalnie obecny na niskim poziomie w produktach mlecznych i jest wytwarzany w ogólnej postaci, wraz z innymi krótkołańcuchowymi kwasami tłuszczowymi, w przewodzie pokarmowym ludzi i innych ssaków, jako końcowy produkt mikrobiologicznego trawienia węglowodanów..
Ma znaczącą aktywność fizjologiczną u zwierząt (Human Metabolome Database, 2017).
Indeks
- 1 Właściwości fizyczne i chemiczne
- 2 Reaktywność i zagrożenia
- 3 Biochemia
- 4 zastosowania
- 5 referencji
Właściwości fizyczne i chemiczne
Kwas propanowy jest bezbarwną i oleistą cieczą o ostrym, nieprzyjemnym i zjełczałym zapachu. Jego wygląd pokazano na rysunku 2 (Narodowe Centrum Informacji Biotechnologicznej, 2017).

Kwas propanowy ma masę cząsteczkową 74,08 g / mol i gęstość 0,992 g / ml. Jego temperatura zamarzania i temperatura wrzenia wynoszą odpowiednio -20,5 ° C i 141,1 ° C. Kwas propanowy jest słabym kwasem, którego pKa wynosi 4,88.
Związek jest bardzo dobrze rozpuszczalny w wodzie, zdolny do rozpuszczenia 34,97 g związku na 100 ml rozpuszczalnika. Jest również rozpuszczalny w etanolu, eterze i chloroformie (Royal Society of Chemistry, 2015).
Kwas propanowy ma pośrednie właściwości fizyczne pomiędzy mniejszymi kwasami karboksylowymi, kwasami mrówkowymi i octowymi oraz większymi kwasami tłuszczowymi.
Pokazuje ogólne właściwości kwasów karboksylowych i może tworzyć pochodne amidowe, estrowe, bezwodnikowe i chlorkowe. Może ulegać alfa-fluorowcowaniu bromem w obecności PBr3 jako katalizatora (reakcja HVZ) z wytworzeniem CH3CHBrCOOH.
Reaktywność i zagrożenia
Kwas propanowy jest materiałem łatwopalnym i łatwopalnym. Może się zapalić przez ciepło, iskry lub płomienie. Pary mogą tworzyć z powietrzem mieszaniny wybuchowe, zdolne do przemieszczania się do źródła zapłonu i wybuchu.
Większość oparów jest cięższa od powietrza. Będą rozprzestrzeniać się po ziemi i będą zbierane na niskich lub zamkniętych obszarach (kanały, piwnice, zbiorniki). Niebezpieczeństwo wybuchu pary w pomieszczeniach, na zewnątrz lub w kanałach.
Substancje oznaczone symbolem (P) mogą polimeryzować wybuchowo po podgrzaniu lub owinięciu w ogień. Pojemniki mogą eksplodować po podgrzaniu (KWAS PROPIONOWY, 2016).
Związek należy trzymać z dala od ciepła lub źródeł zapłonu. Po podgrzaniu do rozkładu wydziela ostry dym i drażniące opary.
Kwas propanowy działa drażniąco na skórę, oczy, nos i gardło, ale nie wywołuje ostrych efektów ogólnoustrojowych i nie ma widocznego potencjału genotoksycznego. W przypadku kontaktu należy umyć dużą ilością wody (Karta charakterystyki substancji niebezpiecznej Kwas propionowy, 2013).
Biochemia
Koniugowana zasada kwasu propanowego, propionianu, tworzy się jako końcowy fragment trzech węgli (aktywowany koenzymem A jako propionylo-CoA) w utlenianiu nieparzystych węglowych kwasów tłuszczowych i utlenianiu bocznego łańcucha cholesterol.
Eksperymenty z radioaktywnymi izotopami propionianu wstrzykiwanymi szczurom na czczo wskazują, że może występować w glikogenie, glukozie, półproduktach cyklu kwasu cytrynowego, aminokwasach i białkach.
Szlak metabolizmu kwasu propanowego obejmuje interakcję z koenzymem A, karboksylację z wytworzeniem metylomalonylo-koenzymu A i konwersję do kwasu bursztynowego, który wchodzi w cykl kwasu cytrynowego.
Kwas propanowy może być utleniany bez tworzenia ciał ketonowych i, w przeciwieństwie do kwasu octowego, jest włączany zarówno w węglowodan, jak i lipid (Bingham, Cohrssen i Powell, 2001).
Kwas kwasu propionowego jest jedną z najczęstszych kwasicy organicznej, choroby obejmującej wiele różnych zaburzeń.
Wyniki pacjentów urodzonych z kwasem propionowym są ubogie we wzorce rozwoju intelektualnego, przy czym 60% ma IQ poniżej 75 i wymaga specjalnego wykształcenia.
Skuteczne przeszczepy wątroby i / lub nerek u kilku pacjentów spowodowały lepszą jakość życia, ale niekoniecznie zapobiegały powikłaniom neurologicznym i trzewnym.
Wyniki te podkreślają potrzebę stałego monitorowania metabolizmu, niezależnie od strategii terapeutycznej.
Używa
Kwas propanowy hamuje wzrost bakterii i pleśni na poziomach od 0,1 do 1% wagowo. W rezultacie większość produkowanego kwasu propanowego jest zużywana jako środek konserwujący zarówno do paszy, jak i do spożycia przez ludzi, takich jak zboża i zboża..
Ochrona paszy, zbóż i żywności, a także produkcja propionianu wapnia i sodu, który stanowi prawie 80% światowego zużycia kwasu propanowego w 2016 r., W porównaniu z 78,5% w 2012 r..
Około 51% światowego zużycia kwasu propanowego jest wykorzystywane do żywienia zwierząt i konserwowania ziarna, podczas gdy prawie 29% jest wykorzystywane do produkcji propionianów wapnia i sodu, które są również stosowane w przemyśle spożywczym i paszowym.
Inne ważne rynki kwasu propanowego to produkcja herbicydów i ketonu dietylowego. Zastosowania o mniejszej objętości obejmują propionian octanu celulozy, farmaceutyki, estry rozpuszczalników, środki aromatyzujące i zapachowe, plastyfikatory, barwniki i środki pomocnicze do tekstyliów, skórę i gumę.
Zapotrzebowanie na kwas propanowy zależy w dużej mierze od produkcji pasz i zbóż, a następnie od pakowanej żywności i produktów piekarniczych.
Perspektywy globalnego wzrostu kwasu propanowego i jego soli w paszach dla zwierząt / zbożu i konserwacji żywności są znaczne (IHS Markit, 2016).
Inne szybko rozwijające się rynki obejmują estry propionianowe dla rozpuszczalników, takie jak propionian n-butylu i pentyl; Estry te są coraz częściej stosowane jako substytuty rozpuszczalników wymienionych jako niebezpieczne zanieczyszczenia powietrza.
Referencje
- Bingham, E., Cohrssen, B. i Powell, C. (2001). Patty's Toxicology Tomy 1-9 5th ed. Nowy Jork: John Wiley & Sons.
- EMBL-EBI (2016, 14 października). kwas propionowy. Odzyskane z ChEBI: ebi.ac.uk.
- Baza danych ludzkich metabolitów. (2017, 2 marca). Kwas propionowy. Pobrane z hmdb.ca: hmdb.ca.
- IHS Markit. (2016, grudzień). Podręcznik ekonomiki chemicznej Kwas propionowy. Pobrane z ihs: ihs.com.
- Karta charakterystyki materiału Kwas propionowy. (2013, 21 maja). Źródło: sciencelab: sciencelab.com.
- National Center for Biotechnology Information ... (2017, 22 kwietnia). PubChem Compound Database; CID = 1032. Źródło: pubchem.ncbi.nlm.nih.gov.
- O'Neil, M. (. (2001), The Merck Index - An Encyclopedia of Chemicals, Drugs and Biologicals, 13 wydanie, New Jersey: Merck and Co., Inc..
- KWAS PROPIONOWY. (2016). Źródło: cameochemicals: cameochemicals.noaa.gov.
- Królewskie Towarzystwo Chemiczne. (2015). Kwas propionowy. Źródło: chemspider: chemspider.com.


