Formuła kwasu podchlorawego (HClO), właściwości i zastosowania
The kwas podchlorawy, znany również jako kwas monokwasowy (I), jest związkiem chemicznym o wzorze HClO. Jest to prosta cząsteczka z centralnym tlenem połączonym z atomami chloru i wodoru za pomocą prostych wiązań.
Jest to kwas tlenowy chloru, który ma wartościowość (I). Jest to słaby kwas, który zazwyczaj powstaje, gdy chlor rozpuszcza się w wodzie. Odnosi się do kilku innych nazw, takich jak: kwas chlorowy, chloranol, podchloryn wodoru i wodorotlenek chloru.
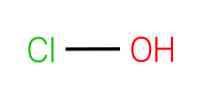
Kwas podchlorawy jest wytwarzany w organizmie człowieka przez białe krwinki w celu zwalczania infekcji, ponieważ działa przeciwko szerokiej gamie mikroorganizmów.
Dodanie chloru do wody daje kwas podchlorawy wraz z kwasem chlorowodorowym (HCl):
Cl2 + H2O ⇌ HOCl + HCl
Powyższa reakcja jest w równowadze i nie jest łatwo wyizolować HOCl z tej mieszaniny. Jednakże stabilne sole podchlorawe można otrzymać przez rozpuszczenie chloru gazowego w roztworze wodorotlenku sodu lub innych wodnych roztworach zasad.
HOCl można także wytworzyć przez rozpuszczenie monotlenku dichloriny w wodzie (zastosowania kwasu podchlorawego, właściwości, struktura i wzór, S.F.).
Cl2O + H2O → 2HOCl
Indeks
- 1 Właściwości fizyczne i chemiczne
- 2 Działanie przeciwbakteryjne
- 3 zastosowania
- 3.1 Tworzenie chlorohydryny
- 3.2 Przemysł kosmetyczny
- 3.3 Uzdatnianie wody
- 3.4 Leczenie świądu
- 4 odniesienia
Właściwości fizyczne i chemiczne
Kwas podchlorawy istnieje tylko w postaci roztworu wodnego. Jest to roztwór bezbarwny, a jego dokładne właściwości fizyczne są zmienne, ponieważ zależą od stężenia roztworu. Bezwodny lub suchy kwas podchlorawy jest niemożliwy do przygotowania, ponieważ cząsteczka istnieje w równowadze z jej bezwodnikiem (National Center for Biotechnology Information., 2017).
Jego masa cząsteczkowa wynosi 52,46 g / mol, a pKa wynosi 7,53. Jest rozpuszczalny w wodzie.
HOCl jest silnym utleniaczem i może tworzyć mieszaniny wybuchowe. Jest to również środek redukujący zdolny do utleniania się do chloru, chloru i nadchlorowych postaci kwasu. W roztworach wodnych, będących słabym kwasem, częściowo dysocjuje w jonie podchlorynowym (OCl-) i H+.
HOCl reaguje z zasadami tworząc sole zwane podchlorynami. Na przykład podchloryn sodu (NaOCl), aktywny składnik wybielacza, powstaje w reakcji kwasu podchlorawego z wodorotlenkiem sodu (Royal Society of Chemistry, 2015).
HOCl + NaOH → NaOCl + H2O
Kwas podchlorawy reaguje również łatwo z różnymi cząsteczkami organicznymi i biocząsteczkami.
Kwas podchlorawy nie jest uważany za szkodliwy, ponieważ występuje w niskim stężeniu w organizmie człowieka i ma działanie przeciwbakteryjne.
Kwas podchlorawy reaguje powoli z DNA i RNA, a także wszystkimi nukleotydami in vitro.
GMP jest najbardziej reaktywny, ponieważ HClO reaguje zarówno z heterocykliczną grupą NH, jak i grupą aminową.
Podobnie, TMP z tylko jedną heterocykliczną grupą NH, która jest reaktywna z HClO, jest drugim najbardziej reaktywnym.
AMP i CMP, które mają tylko jedną powoli reaktywną grupę aminową, są mniej reaktywne z HClO.
Zgłoszono, że UMP reaguje tylko w bardzo wolnym tempie. Heterocykliczne grupy NH są bardziej reaktywne niż grupy aminowe, a ich drugorzędowe chloraminy są zdolne do oddawania chloru.
Reakcje te prawdopodobnie kolidują z parowaniem zasad DNA i zgodnie z tym odnotowano spadek lepkości DNA eksponowanego na HClO podobny do obserwowanego przy denaturacji cieplnej (Prütz, 1996)..
Pozostałości cukru są niereaktywne, a szkielet DNA nie pęka. NADH może reagować z chlorowanym TMP i UMP, a także HClO. Ta reakcja może regenerować UMP i TMP i skutkować pochodną 5-hydroksy NADH.
Reakcja z TMP lub UMP jest powoli odwracalna w celu regeneracji HClO. Druga wolniejsza reakcja powodująca rozszczepienie pierścienia pirydyny zachodzi, gdy obecny jest nadmiar HClO. NAD + jest obojętny wobec HClO.
Działanie przeciwbakteryjne
W ciągu ostatnich 15 lat najbardziej zaawansowane roztwory kwasu podchlorawego oparte na elektrochemii okazały się bezpiecznymi i żywotnymi środkami do oczyszczania ran, jak również uzupełniającymi terapiami w leczeniu zakażeń.
Roztwór podchlorawy (HOCl) jest silnym utleniaczem i ma tendencję do eliminowania elektronów z innej substancji. Sól sodowa, wodorotlenek sodu (NaClO) lub jego sól wapniowa, wodorotlenek wapnia (Ca (ClO) 2) są powszechnie stosowane w wybielaczach, dezodorantach i środkach dezynfekujących.
HOCl istnieje jako naturalny endogenny składnik u ludzi i zwierząt i jest ważną częścią wrodzonego układu odpornościowego. HOCl jest wytwarzany przez granulocyty neutrofilowe, najliczniejszy rodzaj białych krwinek u ssaków. Jest zaangażowany w ostatni etap Szlaku Utleniania w walce z infekcją i inwazją obcych substancji.
Gdy komórka wykrywa inwazję obcej substancji, ulega fagocytozie, podczas której neutrofile spożywają i internalizują mikroorganizmy lub obce cząstki. To zdarzenie fagocytarne powoduje wydzielanie reaktywnych form tlenu i enzymów hydrolitycznych (Kavros, S.F.).
Zużycie tlenu podczas wytwarzania reaktywnych form tlenu, zwane „eksplozją reaktywną”, obejmuje aktywację enzymu oksydazy NADPH, który wytwarza duże ilości nadtlenku.
To wysoce reaktywne formy tlenu rozkładają się na nadtlenek wodoru, który następnie przekształca się w HOCl. HOCl wywiera działanie bakteriobójcze i natychmiast niszczy bakterie połknięte przez neutrofile. Pomimo znacznej aktywności HOCl przeciwko mikroorganizmom, nie jest cytotoksyczny dla komórek ludzkich lub zwierzęcych. Jest to prawdopodobnie związane z jego endogenną obecnością w układzie odpornościowym komórek ssaków (Chanson Water Ionizers USA, Inc, 2016).

Ostatnio zaproponowano, że inaktywacja bakterii przez HOCl jest wynikiem hamowania replikacji DNA. Gdy bakterie są narażone na działanie HOCl, następuje gwałtowny spadek syntezy DNA, który poprzedza zahamowanie syntezy białek, i jest bardzo podobny do utraty żywotności (Davies, 1988)..
Podczas replikacji genomu bakteryjnego, początek replikacji (oriC w E. coli) jest związany z białkami, które są związane z błoną komórkową, i zaobserwowano, że traktowanie HOCl zmniejsza powinowactwo błon wyekstrahowanych dla oriC, i to powinowactwo zmniejsza się równolegle do utraty żywotności.
W pracy Henry'ego Rosen'a (1998) porównali szybkość hamowania HOCl replikacji plazmidowego DNA z różnymi genami replikacji i stwierdzili, że pewne plazmidy wykazują opóźnienie w hamowaniu replikacji w porównaniu z plazmidami, które zawierały oriC. Grupa Rosen zaproponowała, że inaktywacja białek błonowych zaangażowanych w replikację DNA jest mechanizmem działania HOCl.
Używa
Powstawanie chlorohydryn
Kwas podchlorawy stosuje się w syntezie organicznej, przekształcając alkeny w chlorohydryny.
Kwas podchlorawy reaguje z nienasyconymi wiązaniami w lipidach, ale nie w nasyconych wiązaniach, a jon ClO nie bierze udziału w tej reakcji.
Reakcja ta jest wytwarzana przez hydrolizę z dodatkiem chloru do jednego z węgli i jednego hydroksylu do drugiego. Powstały związek jest chlorohydryną. Polarny chlor niszczy dwuwarstwy lipidowe i może zwiększać przepuszczalność.
Gdy tworzenie się chlorohydryny następuje w dwuwarstwach lipidowych krwinek czerwonych, zwiększa się przepuszczalność. Przerwa może wystąpić, jeśli powstanie wystarczająca ilość chlorohydryny.
Dodatek formowanych chlorohydryn do czerwonych krwinek może również wpływać na przepuszczalność. Obserwowano również chlorhydryny cholesterolu, ale nie wpływają one znacząco na przepuszczalność i uważa się, że Cl2 jest odpowiedzialny za tę reakcję
Przemysł kosmetyczny
W przemyśle kosmetycznym stosuje się go jako środek oczyszczający skórę, który korzystnie wpływa na skórę ciała, a nie powoduje wysuszenie. Stosuje się go również w produktach dla niemowląt, ponieważ skóra dziecka jest szczególnie wrażliwa i łatwo się drażni.
Uzdatnianie wody
W leczeniu wody kwas podchlorawy jest aktywnym środkiem dezynfekującym w produktach na bazie podchlorynu (na przykład w basenach).
W usługach gastronomicznych i dystrybucji wody specjalistyczne urządzenia do wytwarzania słabych roztworów HClO z wody i soli są czasami wykorzystywane do wytwarzania odpowiednich ilości bezpiecznego (niestabilnego) środka dezynfekującego do obróbki powierzchni przygotowania żywności i materiałów eksploatacyjnych wody.
Leczenie świądu
Ostatnio zaproponowano miejscowy kwas podchlorawy (HOCl) jako leczenie świądu. Zaproponowano dwa mechanizmy, dzięki którym HOCl może zmniejszyć świąd:
1) HOCl jest bakteriobójczy dla patogenów skórnych, szczególnie Staphylococcus aureus w atopowym zapaleniu skóry.
2) HOCl ma działanie przeciwzapalne i zmniejsza aktywność histaminy, leukotrienu B4 i interleukiny-2, wszystkie zaangażowane w patofizjologię świądu.
Istnieją warunki, w których HOCl może rzeczywiście powodować swędzenie jako niekorzystny efekt. Na przykład HOCl zwiększa aktywność czynnika wzrostu nerwów, co sprzyja świądowi. Długotrwałe narażenie lub wysoka dawka HOCl może również powodować drażniące kontaktowe zapalenie skóry lub rzadziej alergiczne kontaktowe zapalenie skóry (Robert Y. Pelgrift, 2013).
Referencje
- Chanson Water Ionizers USA, Inc. (2016). odkrycie kwasu podchlorawego. Odzyskany z chansonalkalinewater: chansonalkalinewater.com.
- Davies, S. M. (1988). Hamowanie wzrostu bakterii przez kwas podchlorawy. Możliwa rola w aktywności bakteriobójczej fagocytów. Biochem J. 254 (3), 685-692. ncbi.nlm.nih.gov.
- EMBL-EBI (2014, 31 marca). kwas podchlorawy. Źródło: ebi.ac.uk: ebi.ac.uk.
- Henry Rosen, B. R. (1998). Różnicowe działanie utleniaczy mieloperoksydazy na replikację DNA Escherichia coli. Odporność na infekcję. 66 (6), 2655-2659. ncbi.nlm.nih.gov.
- Zastosowania kwasu podchlorawego, właściwości, struktura i wzór. (S.F.). Odzyskane desoftschools: softschools.com.
- Kavros, S. (S.F.). Zastosowanie roztworu kwasu podchlorawego w leczeniu ran. Odzyskany z faim.org.
- National Center for Biotechnology Information ... (2017, 25 marca). PubChem Compound Database; CID = 24341. Pobrane z PubChem.
- Prütz, W. A. (1996). Interakcje z kwasem podchlorawym z tiolami, nukleotydami, DNA i innymi substratami biologicznymi. Archives of Biochemistry and Biophysics Tom 332, Issue 1, 110-120. Odzyskany z sciencedirect.com.
- Robert Y. Pelgrift, A. J. (2013). Miejscowy kwas podchlorawy (HOCl) jako potencjalne leczenie świądu. Current Dermatology Reports, tom 2, numer 3, 181. Źródło: springer.com.
- Królewskie Towarzystwo Chemiczne. (2015). Kwas podchlorawy. Źródło: chemspider: chemspider.com.


