Charakterystyka brucei Trypanosoma, morfologia, cykl biologiczny, objawy
Trypanosoma brucei Jest to pierwotniak pasożytniczy zewnątrzkomórkowy. Należy do klasy Kinetoplastidae, rodzaju Trypanosomatidae Trypanosoma. Istnieją dwa podgatunki, które powodują dwa różne warianty afrykańskiej trypanosomatozy ludzkiej lub zwane „śpiączką”.
Trypanosoma brucei subsp. gambiense, powoduje postać przewlekłą i 98% przypadków, zlokalizowanych w zachodniej i środkowej Afryce Subsaharyjskiej. Trypanosoma brucei subsp. Rhodesian jest przyczyną ostrej formy, obecnej w centrum i na wschód od Afryki subsaharyjskiej.
Oba warianty tej choroby odnotowano w tych krajach Afryki Subsaharyjskiej, w których znaleziono muchę tsetse, Glossina spp, wektor lub czynnik transmisyjny T. brucei.
Trzeci podgatunek, Trypanosoma brucei subsp. brucei, powoduje podobną chorobę u zwierząt domowych i dzikich, zwaną naganą.
„Śpiączka” zagraża ponad 60 milionom ludzi w 36 krajach Afryki Subsaharyjskiej. Jest około 300 000 do 500 000 przypadków rocznie, z czego około 70 000 do 100 000 umiera. Zarażenie muchą tsetse obejmuje obszar 10 milionów kilometrów kwadratowych, jedną trzecią lądu w Afryce.
Światowa Organizacja Zdrowia uznaje znaczący spadek liczby nowych przypadków afrykańskiej ludzkiej trypanosomozy w ostatnich latach. Wynika to z utrzymywania się krajowych i międzynarodowych inicjatyw w celu kontrolowania tej choroby.
Indeks
- 1 Ogólna charakterystyka
- 1.1 Odkrycie
- 1.2 Genetyka
- 1.3 „Śpiączka” i globalne ocieplenie
- 2 Filogeneza i taksonomia
- 3 Morfologia
- 3.1 Formularz Tryomastigote
- 3.2 Formularz Epimastigote
- 3.3 Kinetosom
- 4 Cykl biologiczny
- 4.1 Na hoście (ludzkim lub innym ssaku)
- 4.2 W locie tsetse (wektor)
- 5 Objawy zakażenia
- 5.1 Pierwsza faza
- 5.2 Druga faza
- 5.3 Diagnoza
- 6 Leczenie
- 7 referencji
Ogólna charakterystyka
Nazywa się to „chorobą snu”, ponieważ powoduje odwrócenie naturalnego cyklu snu pacjenta. Osoba śpi w ciągu dnia i nie śpi w nocy. Jest to wynik szeregu zaburzeń psychicznych i neurologicznych, które powoduje choroba w jej zaawansowanej fazie.
Odkrycie
Trypanosomatoza zwierzęca lub nagana jest ważną chorobą u bydła w Afryce. Zidentyfikował się Trypanosoma brucei jako czynnik sprawczy w 1899 roku. David Bruce podczas badania poważnego wybuchu Nagany w Zululand.
Później Aldo Castellani zidentyfikował ten gatunek trypanosomu we krwi i płynie mózgowo-rdzeniowym u ludzi z „śpiączką”.
Pomiędzy 1902 a 1910 r. Zidentyfikowano dwa warianty choroby u ludzi i ich przyczynowych podgatunków. Zarówno zwierzęta, jak i ludzie mogą działać jako rezerwuary pasożytów zdolnych do wywoływania choroby u ludzi.
Genetyka
Genom jądra Trypanosoma brucei składa się z 11 diploidalnych chromosomów i stu mikrochromosomów. W sumie ma 9 068 genów. Genom mitochondriów (kinetoplast) składa się z wielu kopii kolistego DNA.
„Śpiączka” i globalne ocieplenie
Afrykańska ludzka trypanosomoza jest uważana za jedną z 12 chorób zakaźnych u ludzi, które mogą być zaostrzone przez globalne ocieplenie.
Wynika to z faktu, że gdy temperatura otoczenia wzrasta, obszar podatny na zajęcie przez muchę zostanie powiększony. Glossina Sp. Podczas kolonizacji much nowych terytoriów, zabiorą ze sobą pasożyta.
Filogeneza i taksonomia
Trypanosoma brucei pnależy do królestwa Protista, grupa Excavata, typ Euglenozoa, klasa Kinetoplastidae, rząd Trypanosomatida, rodzina Trypanosomatidae, rodzaj Trypanosoma, podgatunek Trypanozoon.
Ten gatunek ma trzy podgatunki, które powodują różne warianty „śpiączki” u ludzi (T. b. subsp. gambiense i T. b. subsp. rHodesian) oraz u zwierząt domowych i dzikich (T. b. subsp. brucei).
Morfologia
Forma Tripomastigote
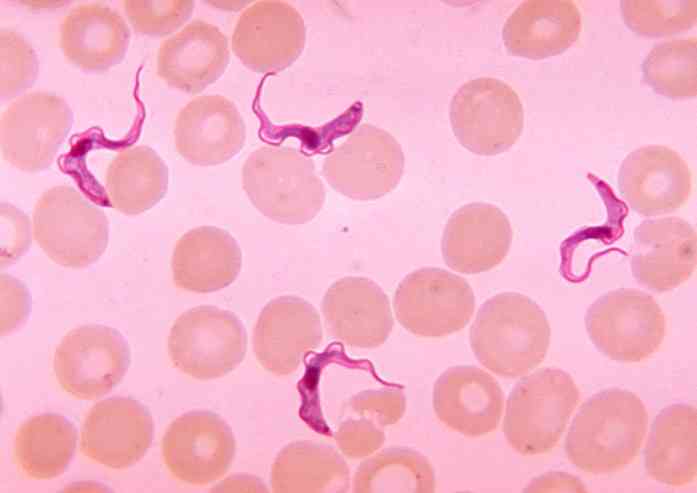
Trypanosoma brucei jest wydłużonym organizmem jednokomórkowym o długości 20 μm i szerokości 1-3 μm, którego kształt, struktura i skład błony zmieniają się w ciągu całego cyklu życia.
Ma dwie podstawowe formy. Forma tripomastygotyczna ciała podstawnego w tylnej części jądra i długiej wici. Ta forma z kolei przyjmuje podtypy podczas cyklu życia. Spośród nich krótki lub skrótowy podtyp (niechlujny w języku angielskim), jest grubszy, a wici są krótkie.
Formularz Epimastigote
Drugą podstawową postacią jest epimastigota ciała podstawowego w stosunku do jądra i wici nieco krótsza niż poprzednia.
Komórka jest pokryta warstwą zmiennej powierzchniowej glikoproteiny. Warstwa ta zmienia glikoproteiny na swojej powierzchni i dzięki temu wymyka się atakowi przeciwciał wytwarzanych przez gospodarza.
Układ odpornościowy wytwarza nowe przeciwciała, aby zaatakować nową konfigurację warstwy i warstwa zmienia się ponownie. Jest to tak zwana odmiana antygenowa.
Kinetosoma
Ważną cechą jest obecność kinetosomy. Struktura ta składa się ze skondensowanego mitochondrialnego DNA znajdującego się w jedynym obecnym mitochondriach. Ta duża mitochondria znajduje się u podstawy plagi.
Cykl biologiczny
Cykl życia Trypanosoma brucei zmienia się między muchą tsetse jako wektorem a człowiekiem jako gospodarzem. Aby rozwinąć się w tak różnych gospodarzach, pierwotniak przechodzi ważne przemiany metaboliczne i morfologiczne między sobą.
W locie Trypanosoma brucei zamieszkuje przewód pokarmowy, podczas gdy u człowieka znajduje się we krwi.
Na gospodarzu (człowiek lub inny ssak)
Trypanosoma brucei W całym cyklu występuje w trzech podstawowych formach. Gdy mucha gryzie człowieka lub innego ssaka, aby wyodrębnić jego krew, wstrzykuje się z gruczołów ślinowych do krwiobiegu nieproliferacyjną formę pierwotniaka, zwanego metaklikiem.
W krwiobiegu przekształca się w formę proliferacyjną, zwaną smukłą krwią (smukły po angielsku).
Smukła forma krwi Trypanosoma brucei pobiera energię z glikolizy glukozy obecnej we krwi. Ten proces metaboliczny odbywa się w organelli zwanej glikozomą. Te trypanosomy namnażają się w różnych płynach ustrojowych: krwi, limfie i płynie mózgowo-rdzeniowym.
Wraz ze wzrostem liczby pasożytów we krwi zaczynają one ponownie zmieniać się w formę nieproliferacyjną. Tym razem jest to grubszy wariant z krótszą wici, zwaną pulchną krwią (krępy).
Trypanosomy krwi bulwiastej są dostosowane do warunków układu pokarmowego muchy. Aktywują swoje mitochondria i enzymy niezbędne do cyklu kwasów cytrynowych i łańcucha oddechowego. Źródłem energii nie jest już glukoza, ale prolina.
W locie tse-tsé (wektor)
Wektor lub czynnik transmisyjny Trypanosoma brucei to mucha tse-tse, Glossina spp. Ten rodzaj grupuje od 25 do 30 gatunków much krwiotwórczych. Łatwo je odróżnić od zwykłej muchy dzięki szczególnie długiej trąbce i całkowicie złożonym skrzydłom w spoczynku.
Gdy mucha tsetse gryzie zainfekowanego ssaka gospodarza i wydobywa krew, te krótkie formy krwi penetrują wektor.
Gdy w przewodzie pokarmowym muchy, krótkie formy krwi szybko różnicują się w procykliczne proliferacyjne trypanosomy.
Mnożą się przez rozszczepienie binarne. Opuszczają przewód pokarmowy muchy i idą do gruczołów ślinowych. Są one przekształcane w epimastigoty zakotwiczone w ścianach przez plagę.
W gruczołach ślinowych rozmnażają się i przekształcają w metacykliczne trypanosomy, gotowe do ponownego zaszczepienia w układzie krwionośnym ssaka.
Objawy zakażenia
Okres inkubacji tej choroby wynosi 2 do 3 dni po ugryzieniu muchy. Objawy neurologiczne mogą wystąpić po kilku miesiącach w przypadku T. b. subsp. gambiense. Jeśli chodzi o T. b. subsp. Rhodesian, manifestowanie się może zająć lata.
Pierwsza faza
„Śpiączka” ma dwa etapy. Pierwsza nazywa się fazą wczesnego stadium lub fazą limfatyczną, charakteryzuje się obecnością Trypanosoma brucei tylko we krwi i limfie.
W tym przypadku objawami są gorączka, bóle głowy, bóle mięśni, wymioty, obrzęk węzłów chłonnych, utrata masy ciała, osłabienie i drażliwość.
W tej fazie chorobę można pomylić z malarią.
Druga faza
Tak zwany późny etap lub faza neurologiczna (stan mózgu) jest aktywowany wraz z pojawieniem się pasożyta w ośrodkowym układzie nerwowym, wykrywanym w płynie mózgowo-rdzeniowym. Tutaj objawy są wyrażane jako zmiany w zachowaniu, dezorientacja, brak koordynacji, zmiana cyklu snu i wreszcie śpiączka.
Rozwój choroby trwa do trzech lat w przypadku podgatunków gambiense, kończący się śmiercią. Kiedy obecny jest podgatunek Rhodesian, śmierć trwa od tygodni do miesięcy.
Spośród przypadków nie poddanych leczeniu, 100% umiera. Zginęły również 2-8% leczonych przypadków.
Diagnoza
Etap diagnostyczny występuje wtedy, gdy we krwi znajduje się forma zakaźna, mianowicie trypanosom we krwi.
Za pomocą mikroskopowego badania próbek krwi wykrywa się specyficzną postać pasożyta. W fazie mózgowo-rdzeniowej nakłucie lędźwiowe jest wymagane do analizy płynu mózgowo-rdzeniowego.
Istnieje kilka technik molekularnych do diagnozowania obecności Trypanosoma brucei.
Leczenie
Pojemność, która ma Trypanosoma brucei ciągłego zmieniania konfiguracji zewnętrznej warstwy glikoprotein (zmienność antygenowa), bardzo utrudnia opracowanie szczepionek przeciwko „śpiączce”.
Nie ma profilaktycznej chemioterapii i mało lub wcale nie ma szczepionki. Cztery główne leki stosowane w ludzkiej trypanosomozie afrykańskiej są toksyczne.
Melarsoprol jest jedynym lekiem skutecznym w obu wariantach choroby ośrodkowego układu nerwowego. Jest jednak tak toksyczny, że zabija 5% pacjentów, którzy go otrzymują.
Eflornityna, sama lub w połączeniu z nifurtimoksem, jest coraz częściej stosowana jako pierwsza linia leczenia choroby spowodowanej przez Trypanosoma brucei subsp. gambiense.
Referencje
- Fenn K i KR Matthews (2007) Biologia komórki różnicowania Trypanosoma brucei. Aktualna opinia w mikrobiologii. 10: 539-546.
- Fernández-Moya SM (2013) Charakterystyka funkcjonalna białek wiążących RNA RBP33 i DRBD3 jako regulatorów ekspresji genów Trypanosoma brucei. TEKST DOKTORALNY. Instytut Parazytologii i Biomedycyny „López-Neyra”. Redakcja Uniwersytetu w Granadzie, Hiszpania. 189 str.
- García-Salcedo JA, D Pérez-Morga, P Gijón, V Dilbeck, E Pays i DP Nolan (2004) Różnorodna rola aktyny w cyklu życiowym Trypanosoma brucei. Dziennik EMBO 23: 780-789.
- Kennedy PGE (2008) Ciągły problem ludzkiej trypanosomozy afrykańskiej (śpiączka). Annals of Neurology, 64 (2), 116-126.
- Matthews KR (2005) Biologia komórek rozwojowych Trypanosoma brucei. J. Celi Sci. 118: 283-290.
- Welburn SC, EM Fèvre, PG Coleman, M Odiit i I Maudlin (2001) Śpiąca choroba: opowieść o dwóch chorobach. TRENDY w parazytologii. 17 (1): 19-24.


