Charakterystyka Acinetobacter baumannii, morfologia, metabolizm
Acinetobacter baumannii Jest to bakteria Gram-ujemna, należąca do rzędu pseudomonas. W całej swojej historii taksonomicznej znajduje się w rodzajach Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea i Achromobacter, dopóki nie znalazł się w swoim obecnym gatunku w 1968 roku.
A. baumannii Jest to bakteria chorobotwórcza, uważana za gatunek najczęściej zaangażowany w zakażenia w obrębie swojego rodzaju. Uczestniczyła w różnego rodzaju zakażeniach, takich jak posocznica, zapalenie płuc i zapalenie opon mózgowych..
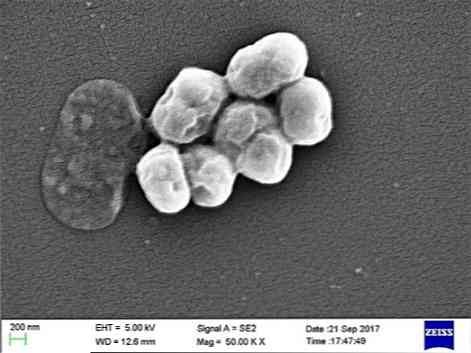
Jest to pasożyt oportunistyczny, który ma znaczną częstość występowania w chorobach szpitalnych lub szpitalnych. Transmisja przez wentylację mechaniczną została wskazana jako ważna przyczyna infekcji, szczególnie w oddziałach intensywnej terapii.
Pomimo tego, że jest uważany za patogen niskiej jakości, ma zdolność do zwiększania zjadliwości szczepów zaangażowanych w częste infekcje. Ma dużą zdolność do rozwijania oporności i oporności na antybiotyki.
W szpitalach przekazuje się go głównie poprzez kontakt personelu, użycie skażonych materiałów szpitalnych, a także w powietrzu na krótkich dystansach..
Światowa Organizacja Zdrowia obejmuje A. baumannii na liście opornych patogenów, dla których pilnie potrzebne są nowe antybiotyki, przypisując kategorię 1, z priorytetem krytycznym.
Indeks
- 1 Cechy biologiczne
- 2 Morfologia
- 3 Metabolizm
- 4 Odporność na antybiotyki
- 5 Patologie
- 6 objawów
- 7 Leczenie
- 8 Odniesienia
Cechy biologiczne
Wszystkie gatunki z rodzaju Acinetobacter mają szeroki rozkład w różnych naturalnych niszach. A. baumannii może naturalnie zamieszkiwać skórę zdrowych ludzi, będąc w stanie skolonizować powierzchnie śluzowe, co stanowi ważny zbiornik epidemiologiczny. Jednak siedlisko A. baumannii to prawie wyłącznie w środowiskach szpitalnych.
Bakteriom tym brakuje wici lub struktur używanych do poruszania się. Jednak osiągają one ruch przez struktury, które umożliwiają im rozszerzanie się i wycofywanie, oraz mechanizmy chemiczne, takie jak wydalanie filmu egzopolisacharydu o wysokiej masie cząsteczkowej za bakterią..
A. baumannii potrafi skolonizować dużą liczbę środowisk żywych lub obojętnych i ma wielką zdolność przetrwania na sztucznych powierzchniach przez dłuższy czas.
Ta pojemność jest prawdopodobnie spowodowana jego zdolnością do przeciwstawiania się odwodnieniu, wykorzystywania różnych źródeł węgla przez różne drogi metaboliczne i możliwości tworzenia biofilmów. Z tego powodu często spotyka się je w sprzęcie szpitalnym, takim jak cewniki i urządzenia do wentylacji mechanicznej.
Morfologia
A. baumannii jest coccobacillusem o pośrednim kształcie między kokosami i laskami. Mierzą od 1,5 do 2,5 na 1 do 1,5 mikrona, gdy populacje są w fazie logarytmicznej wzrostu. Są bardziej kuliste, gdy osiągają fazę stacjonarną.
Metabolizm
Bakteria A. baumannii nie jest fermentatorem glukozy; jest ściśle tlenowy, to znaczy wymaga metabolizmu tlenu.
Gatunki z rodzaju Acinetobacter są jedynymi z rodziny Moraxellaceae, którym brak oksydaz cytochromu c, dla których dają one negatywne wyniki w testach oksydaz.
A. baumannii rośnie w temperaturach od 20 do 44 ° C, a optymalna temperatura wynosi od 30 do 35 ° C.
Odporność na antybiotyki
Stałe wytwarzanie oporności na antybiotyki nie tylko utrudnia leczenie i kontrolę zakażeń wytwarzanych przez A. baumannii, promuje także wybór endemicznych i epidemicznych szczepów wieloopornych.
Niektóre wewnętrzne mechanizmy A. baumannii, które promują odporność na antybiotyki:
- Obecność β-laktamazy nadają oporność na b-laktamy.
- Wytwarzanie specyficznych enzymów, takich jak amoniglukozyd-3'-fosfotransferaza VI, dezaktywuje amikacynę.
- Obecność oksacylinazy OXA-51 hydrolizuje penicyliny i karbapenemy.
- Obecność i nadekspresja pomp refluksowych, które są pompami wyrzucającymi małe cząsteczki poza komórkę, które penetrują cytoplazmę, zmniejszając w ten sposób ich podatność na antybiotyki.
Biofilmy generowane przez A. baumannii zmieniają metabolizm mikroorganizmów, zmniejszając ich wrażliwość na antybiotyki, a także zapewniając fizyczną barierę przed dużymi cząsteczkami i zapobiegając odwodnieniu bakterii.
Patologie
A. baumannii kolonizuje nowego gospodarza przez kontakt z zakażonymi ludźmi lub skażonym sprzętem medycznym. Po pierwsze bakterie przylegają do skóry i powierzchni śluzówki. Aby się rozmnażać, musi przetrwać środki antybiotykowe i hamujące oraz warunki tych powierzchni.
Wzrost liczby bakterii na powierzchniach śluzówki, szczególnie w warunkach hospitalizacji w kontakcie z cewnikami wewnątrznaczyniowymi lub rurkami dotchawiczymi, może sprzyjać ryzyku zakażenia dróg oddechowych i krwiobiegu..
Zapalenie płuc w szpitalach jest najczęstszą infekcją wywoływaną przez A. baumanii. Powszechnie przyjmowane na oddziałach intensywnej terapii przez pacjentów otrzymujących wspomagane mechanicznie oddychanie.
A. baumanii Wywołało to również poważne problemy z powodu infekcji personelu wojskowego traumą powojenną, szczególnie w Iraku i Afganistanie. W szczególności z powodu zapalenia szpiku i zakażeń tkanek miękkich, które mogą powodować martwicę i zapalenie tkanki łącznej.
Istnieje również ryzyko zapalenia opon mózgowych A. baumanii u pacjentów wychodzących z neurochirurgii.
Osoby podatne na zakażenie przez A. baumanii obejmują te, które zostały uprzednio poddane stosowaniu antybiotyków, poważnych operacji, oparzeń, urazów, immunosupresji lub stosowania inwazyjnych urządzeń medycznych, głównie wentylacji mechanicznej, w oddziałach intensywnej terapii.
Objawy
Nie ma specyficznej symptomatologii zakażeń z powodu A. baumanii. Każda z różnych infekcji wytwarzanych przez tę bakterię ma swoje charakterystyczne objawy.
Ogólnie objawy zakażeń, które mogą obejmować A. baumanii lub inne oportunistyczne bakterie, takie jak Klebsiella pneumoniae i Streptococcus pneumoniae, może obejmować gorączkę, dreszcze, wysypkę, bolesne oddawanie moczu, pilną potrzebę częstego oddawania moczu, splątanie lub zmienione stany umysłowe, nudności, bóle mięśni, bóle w klatce piersiowej i kaszel.
Leczenie
Antybiotyki w leczeniu zakażeń A. baumannii są one bardzo ograniczone, ze względu na ich wielką zdolność do uzyskiwania odporności i odporności wielordzeniowej. Dlatego ważne jest, aby określić podatność każdego szczepu na różne antybiotyki, aby zapewnić skuteczność każdego leczenia.
Ze względu na oporność na karbapenemy stosowano polimyksyny, zwłaszcza kolistynę, pomimo stosunkowo niskiego wskaźnika oporności i skutków ubocznych na nerki..
Jednak szczepy oporne na kolistynę zostały już wykryte. Jako alternatywę dla oporności na te antybiotyki zastosowano terapię skojarzoną.
Referencje
- Bergogne-Bérézin, E. & Towner, K.J.. Acinetobacter spp. jako patogeny szpitalne: cechy mikrobiologiczne, kliniczne i epidemiologiczne. Clin Microbiol Rev, 9 (1996), str. 148-165.
- Fournier, P.E., Richet, H. (2006). Epidemiologia i kontrola Acinetobacter baumanii w placówkach służby zdrowia. Clinical Infectious Diseases, 42: 692-9.
- Hernández Torres, A., García Vázquez, E., Yagüe, G. &, Gómez Gómez, J. (2010) Acinetobacter baumanii multiresistant: aktualna sytuacja kliniczna i nowe perspektywy Spanish Journal of Chemotherapy, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: Epidemiologia, oporność na środki przeciwdrobnoustrojowe i możliwości leczenia. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.j., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: infekcje u ludzi, czynniki przyczyniające się do patogenezy i modele zwierzęce. FEMS Microbiology Reviews, 37: 130-155.
- Peleg, A.Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: pojawienie się skutecznego patogenu. Clinical Microbiology Reviews, 21 (3): 538-82.
- Vanegas-Múnera, J.M., Roncancio-Villamil, G. & Jiménez-Quiceno, J.N. (2014). Acinetobacter baumannii: znaczenie kliniczne, mechanizmy oporności i diagnoza. CES Medicine Journal, 28 (2): 233-246.


