Formuła siarczanu sodu, właściwości, struktura, zastosowania
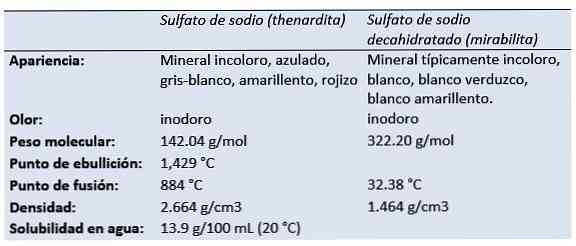
The siarczan sodu (sól disodowa kwasu siarkowego, tetraoksydosiarczan disodowy, siarczan sody, sól Glaubera, thenardite, mirabilit) jest związkiem nieorganicznym o wzorze Na2TAK4 i związane z nim hydraty. Wszystkie formy są białymi ciałami stałymi, które są wysoce rozpuszczalne w wodzie.
Uważany jest za jeden z głównych produktów chemicznych sprzedawanych na rynku. Jego światowa produkcja (prawie wyłącznie w postaci dekahydratu) wynosi około 6 milionów ton rocznie.

Thenardite jest bezwodnym minerałem siarczanu sodu, który powstaje w suchych środowiskach wyparnych, w suchych jaskiniach, w starych kopalniach jako wykwity i jako depozyt wokół fumaroli.
Został po raz pierwszy opisany w 1825 roku w Salinas Espartinas (Ciempozuelos, Madryt, Hiszpania) i został nazwany thenardita na cześć francuskiego chemika Louisa Jacquesa Thénarda (1777-1826).

Holenderski / niemiecki chemik i aptekarz Johann Rudolf Glauber (1604-1670) odkrył w 1625 r. W wodzie austriackiej wiosny dekahydrat siarczanu sodu (później znany jako sól Glaubera). Nazwał to solą mirabilis (cudowna sól), ze względu na swoje właściwości lecznicze.
W latach 1650–1660 Glauber zaczął wytwarzać siarczan sodu z soli kuchennej (NaCl) i stężonego kwasu siarkowego. Ten proces jest uważany za początek przemysłu chemicznego.
Jego kryształy były używane jako środek przeczyszczający aż do XX wieku.
W XVIII wieku reakcja soli Glaubera z potażem (węglan potasu) zaczęła być stosowana w przemysłowej produkcji sody kalcynowanej (węglanu sodu).

Jest obecnie stosowany głównie do produkcji detergentów oraz w procesie Kraft do produkcji masy papierniczej (dominująca metoda w produkcji papieru).
Złoża mineralne siarczanu sodu występują w Stanach Zjednoczonych, Kanadzie, Hiszpanii, Włoszech, Turcji, Rumunii, Meksyku, Botswanie, Chinach, Egipcie, Mongolii i RPA.
Głównymi producentami są Chiny (prowincje Jiangsu i Syczuan), a następnie Hiszpania, gdzie znajduje się największy depozyt glauberytu na świecie (w Cerezo de Río Tirón, Burgos).
Całkowita światowa produkcja naturalnego siarczanu sodu szacowana jest na około 8 milionów ton, a uzyskana jako produkt uboczny innych procesów przemysłowych w przedziale od 2 do 4 Mt.
W Hiszpanii, zgodnie z informacjami opublikowanymi w Krajowym spisie zasobów siarczanu sodu i innymi zaktualizowanymi danymi, szacunkowe zapasy minerałów siarczanowych sodu rzędu 730 Mt skatalogowanych jako „rezerwy” i 300 Mt bardziej skatalogowanych jako „inne zasoby”.
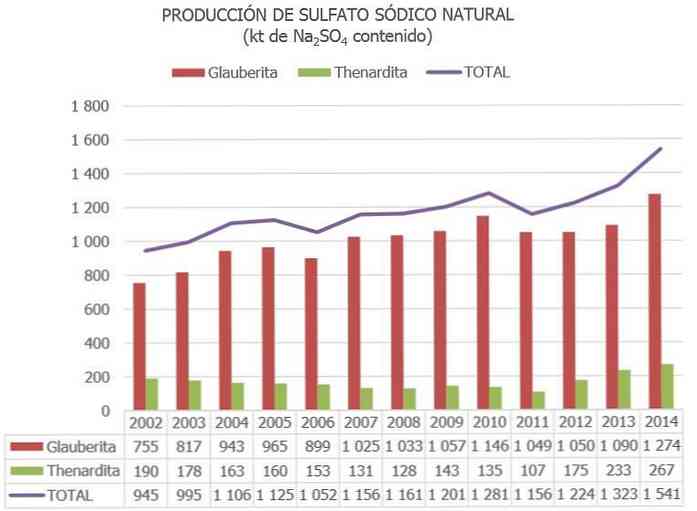
W Unii Europejskiej Hiszpania jest obecnie jedynym krajem z rudami siarczanu sodu (głównie z Thenardite, Glauberite i Mirabilite).
Obecnie obserwuje się ogólny spadek popytu na siarczan sodu w sektorze tekstylnym.
W ostatnich latach inne sektory, takie jak detergenty, odnotowały pewien wzrost w niektórych regionach ze względu na niską cenę jako surowiec.
Główne rozwijające się rynki detergentów siarczanowych sodu znajdują się w Azji, Ameryce Środkowej i Ameryce Południowej.
Wzory

Struktura 2D
Struktura 3D
Funkcje
Właściwości fizyczne i chemiczne
Siarczan sodu należy do grupy reaktywnej związków sodu i należy również do grupy siarczanów, wodorosiarczanów i disiarczków.
Palność
Jest to substancja niepalna. Nie ma ryzyka wybuchu jego proszków.
Reaktywność
Siarczan sodu jest bardzo dobrze rozpuszczalny w wodzie i higroskopijny. Jest bardzo stabilny, nie reaguje z większością środków utleniających lub redukujących w normalnych temperaturach. W wysokich temperaturach można go przekształcić w siarczek sodu przez redukcję karbotermiczną.
Substancje niereaktywne chemicznie uważa się za niereaktywne w typowych warunkach środowiskowych (chociaż mogą reagować w stosunkowo ekstremalnych warunkach lub w katalizie). Są odporne na utlenianie i redukcję (z wyjątkiem ekstremalnych warunków).
Niebezpieczne reakcje chemiczne
Gdy aluminium topi się razem z siarczanem sodu lub potasu, następuje gwałtowna eksplozja.
Toksyczność
Substancje niereaktywne chemicznie są uważane za nietoksyczne (chociaż substancje gazowe z tej grupy mogą działać jak substancje duszące).
Chociaż siarczan sodu jest ogólnie uważany za nietoksyczny, należy obchodzić się z nim ostrożnie. Proszek może powodować astmę lub tymczasowe podrażnienie oczu. Ryzyku tego można uniknąć, nosząc okulary ochronne i papierową maskę.
Używa
Jego główne zastosowania to:
- proszek detergentowy.
- miazga papierowa.
- tekstylia.
- szkło.
- synteza enzymów (produkcja wina).
- żywność dla ludzi i zwierząt.
- produkty apteczne.
- podstawowa chemia w ogóle.
- procesy stalowe.
- Proszek do prania
Siarczan sodu jest bardzo tanim materiałem. Jego największym zastosowaniem jest wypełniacz w detergentach w proszku do użytku domowego, zużywający ok. 50% światowej produkcji. Nowe kompaktowe lub płynne detergenty nie zawierają siarczanu sodu, więc to zastosowanie maleje.
Kolejne zastosowanie siarczanu sodu, którego znaczenie maleje, zwłaszcza w USA. i Kanada, jest w procesie Kraft do produkcji pulpy drzewnej. Postępy w sprawności cieplnej procesu drastycznie zmniejszyły zapotrzebowanie na siarczan sodu.
Przemysł szklarski dostarcza kolejnego ważnego zastosowania dla siarczanu sodu. Jest to druga co do wielkości aplikacja w Europie. Siarczan sodu służy do eliminacji małych pęcherzyków powietrza ze stopionego szkła.
W Japonii największym zastosowaniem siarczanu sodu jest produkcja tekstyliów. Siarczan sodu pomaga barwnikom wnikać równomiernie we włókna i nie powoduje korozji naczyń ze stali nierdzewnej stosowanych do barwienia (w przeciwieństwie do chlorku sodu, który jest alternatywną metodą).
Siarczan sodu jest szczególnie odpowiedni do przechowywania ciepła słonecznego niskiej jakości (do późniejszego uwalniania w zastosowaniach grzewczych) ze względu na jego wysoką zdolność magazynowania ciepła podczas zmiany fazy ze stałej na ciekłą, która jest podawana w temperaturze 32 ° C.
W przypadku zastosowań do chłodzenia mieszanina z pospolitą solą chlorku sodu (NaCl) obniża temperaturę topnienia do 18 ° C.
W laboratorium bezwodny siarczan sodu jest szeroko stosowany jako obojętny środek suszący, w celu usunięcia śladów wody z roztworów organicznych. Jego działanie jest wolniejsze niż siarczanu magnezu, ale można go stosować z różnymi materiałami, ponieważ jest chemicznie zupełnie obojętne.
Dekahydrat siarczanu sodu (sól Glaubera) był historycznie stosowany jako środek przeczyszczający. Jest skuteczny w eliminacji niektórych leków, takich jak acetaminofen (acetaminofen) z organizmu po przedawkowaniu.
Inne zastosowania siarczanu sodu obejmują jego zastosowanie jako dodatku do produkcji odświeżaczy powietrza do dywanów, jako dodatku do pasz dla zwierząt gospodarskich i do produkcji skrobi.
Efekty kliniczne
Do zastosowań terapeutycznych siarczan sodu należy do kategorii soli fizjologicznej i przeczyszczających środków przeczyszczających stosowanych w leczeniu zaparć.
Środki przeczyszczające solą fizjologiczną są solami, które zatrzymują płyny w jelicie przez działanie osmotyczne niezabsorbowanej soli, powodując pośrednio wzrost perystaltyki.
Środki przeczyszczające w postaci soli fizjologicznej są słabo wchłaniane przez przewód pokarmowy, dlatego toksyczność układowa jest mało prawdopodobna, chyba że zostaną połknięte ogromne ilości. Jednak duże narażenie może powodować odwodnienie i zmiany elektrolitowe wtórne do efektów osmotycznych związku.
Przewlekłe nadużywanie środków przeczyszczających może wystąpić u pacjentów z zaburzeniami odżywiania, zespołem Munchausena lub zaburzeniami sztucznymi. Na ogół pacjenci doświadczają nudności, wymiotów i biegunki związanej ze skurczami brzucha. Ciężkie skutki mogą obejmować odwodnienie, niedociśnienie, hipernatremię i zaburzenia elektrolitowe.
Bezpieczeństwo i ryzyko
Oświadczenia o zagrożeniach globalnie zharmonizowanego systemu klasyfikacji i oznakowania chemikaliów (SGA).
Globalnie Zharmonizowany System Klasyfikacji i Oznakowania Chemikaliów (SGA) jest systemem uzgodnionym na szczeblu międzynarodowym, stworzonym przez Organizację Narodów Zjednoczonych w celu zastąpienia różnych standardów klasyfikacji i oznakowania stosowanych w różnych krajach poprzez stosowanie spójnych kryteriów globalnych (Organizacja Narodów Zjednoczonych United, 2015).
Klasy zagrożeń (i odpowiadający im rozdział GHS), normy klasyfikacji i oznakowania oraz zalecenia dotyczące siarczanu sodu są następujące (Europejska Agencja Chemikaliów, 2017, Organizacja Narodów Zjednoczonych, 2015, PubChem, 2017):
Klasy zagrożenia GHS
H315: Działa drażniąco na skórę [Ostrzeżenie Działanie żrące / drażniące na skórę - Kategoria 2].
H317: Może powodować reakcję alergiczną skóry [Ostrzeżenie: działanie uczulające, skóra - Kategoria 1].
H319: Działa drażniąco na oczy [Ostrzeżenie Poważne uszkodzenie oczu / działanie drażniące na oczy - Kategoria 2A].
H412: Działa szkodliwie na organizmy wodne, powodując długotrwałe niekorzystne skutki [Stwarzające zagrożenie dla środowiska wodnego, zagrożenie długoterminowe - kategoria 3].
(PubChem, 2017)
Kody rad ostrożnościowych
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 i P501.
Referencje
- ChemIDplus (2017) Struktura 3D 7757-82-6 - Bezwodny siarczan sodu [image]. Źródło: chem.nlm.nih.gov.
- ChemIDplus (2017) Struktura 3D 7727-73-3 - Siarczan sodu [USP] [image]. Źródło: chem.nlm.nih.gov.
- Dyet, D. (2007) Thenardite Siarczan sodu w pobliżu Sodaville Mineral County Nevada [image] Źródło: en.wikipedia.org.
- Europejska Agencja Chemikaliów (ECHA), (2017). Podsumowanie klasyfikacji i oznakowania. Klasyfikacja zharmonizowana - załącznik VI do rozporządzenia (WE) nr 1272/2008 (rozporządzenie CLP). Siarczan sodu.
- Grumetisho (2012) Mirabilita [image] Źródło: es.wikipedia.org.
- Bank danych substancji niebezpiecznych (HSDB). TOXNET (2017). Siarczan sodu Bethesda, MD, EU: National Library of Medicine. Źródło: toksnet.nlm.nih.gov.
- Instytut Geologiczny i Górniczy Hiszpanii (IGME) (2016). GLAUBERITA-THENARDITA (NATURAL SODIUM SULPHATE) 2014. Panorama górnicza. Źródło: igme.es.
- Narodowy Instytut Bezpieczeństwa w Pracy (INSHT). (2010). Międzynarodowe rekordy bezpieczeństwa chemicznego. Siarczan sodu. Ministerstwo Zatrudnienia i Bezpieczeństwa. Madryt ES Źródło: insht.es.
- Langbein Rise (2008) Continuous kraft pulp mil [image] Źródło: wikimedia.org.
- Organizacja Narodów Zjednoczonych (2015). Globalnie Zharmonizowany System Klasyfikacji i Oznakowania Produktów Chemicznych (SGA) Szósta edycja poprawiona. Nowy Jork, Stany Zjednoczone: publikacja ONZ. Źródło: unece.org.
- National Center for Biotechnology Information. PubChem Compound Database (2016) siarczan sodu - PubChem Struktura [image] Bethesda, MD, EU: National Library of Medicine. Źródło: pubchem.ncbi.nlm.nih.gov.
- National Center for Biotechnology Information. PubChem Compound Database (2016) siarczan sodu - PubChem Structure [image] Bethesda, MD, EU: National Library of Medicine.
- National Center for Biotechnology Information. Baza danych PubChem. (2017). Dekahydratowany siarczan sodu. Bethesda, MD, EU: National Library of Medicine. Źródło: pubchem.ncbi.nlm.nih.gov.
- National Center for Biotechnology Information. Baza danych PubChem. (2017). Siarczan sodu Bethesda, MD, EU: National Library of Medicine. Źródło: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Siarczan sodu [image] Źródło: wikimedia.org.
- Proces Wikipedii (2017) Kraft. Źródło: wikipedia.org.
- Wikipedia (2017) Mirabilita. Źródło: wikipedia.org.
- Wikipedia (2017) Mirabilite. Źródło: wikipedia.org.
- Wikipedia (2017) Siarczan sodu. Źródło: wikipedia.org.
- Wikipedia (2017) Decaidrate Solfato di sodu. Źródło: https://it.wikipedia.org.
- Wikipedia (2017) Siarczan sodu. Źródło: wikipedia.org.
- Wikipedia (2017) Thenardita. Źródło: wikipedia.org.
- Wikipedia (2017) Thenardite. Źródło: .wikipedia.org.


