Struktura chemiczna propylenu, właściwości i zastosowania
The propylen lub propen w temperaturze pokojowej i pod ciśnieniem atmosferycznym jest w stanie gazowym i, podobnie jak inne alkeny, jest bezbarwny. Ma zapach podobny do oleju, ale mniej intensywny. Ma moment dipolowy, ponieważ pomimo braku silnego ogniwa polarnego jego cząsteczka jest asymetryczna.
Ponadto propylen jest strukturalnym izomerem cyklopropanu (mają taki sam wzór chemiczny C)3H6). Występuje w przyrodzie jako konsekwencja procesów wegetacji i fermentacji. Sztucznie występuje podczas przetwarzania paliw kopalnych, takich jak ropa naftowa, gaz ziemny i, w mniejszym stopniu, węgiel.

Podobnie, etylen i propylen są produktami rafinacji ropy naftowej w procesie rozszczepiania dużych cząsteczek węglowodorów w celu wytworzenia małych węglowodorów o dużym zapotrzebowaniu..
Propylen można również uzyskać przy użyciu różnych metodologii:
- Reagowanie odwracalnie etylenu i butenu, gdzie podwójne wiązania są łamane i przeformułowywane, dając propylen.
- Poprzez proces odwodornienia propanu.
- W ramach programu produkcji olefin z metanolu (MTO) wytwarzano propylen z metanolu. Przepuszczano go przez katalizator zeolitowy, który sprzyja jego odwodnieniu i prowadzi do powstawania etylenu i propylenu.
3CH3OH (metanol) => CH3CH = CH2 (propylen) + 3H2O (woda)
Indeks
- 1 Struktura chemiczna
- 2 Właściwości
- 2.1 Masa cząsteczkowa
- 2.2 Temperatura wrzenia
- 2.3 Temperatura topnienia
- 2.4 Temperatura zapłonu
- 2.5 Rozpuszczalność
- 2.6 Rozpuszczalność wyrażona jako masa
- 2.7 Gęstość
- 2.8 Gęstość pary
- 2.9 Ciśnienie pary
- 2.10 Samozapłon
- 2.11 Lepkość
- 2.12 Ciepło spalania
- 2.13 Ciepło parowania
- 2.14 Napięcie powierzchniowe
- 2.15 Polimeryzacja
- 2.16 Punkt zamarzania
- 2.17 Próg zapachu
- 3 zastosowania
- 3.1 Polipropylen
- 3.2 Akrylonitryl
- 3.3 Tlenek propylenu
- 3.4 Do syntezy alkoholi i innych zastosowań
- 4 odniesienia
Struktura chemiczna
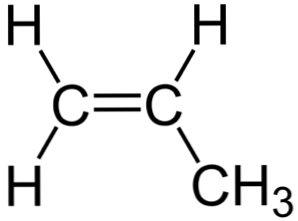
Na powyższym zdjęciu widać strukturę chemiczną propylenu, w której jego asymetria się wyróżnia (prawa strona różni się od lewej). Jego szkielet węglowy, nie licząc atomów H, można zaobserwować jako bumerang.
Ten bumerang przedstawia nienasycenie lub podwójne wiązanie na jednej ze swoich stron (C)1) i dlatego jest płaska ze względu na hybrydyzację sp2 atomów węgla.
Jednak druga strona jest zajęta przez grupę metylową (-CH3), którego hybrydyzacja jest sp3 i ma geometrię czworościenną. Widząc to z przodu, bumerang jest płaski z atomami H wystającymi z niego w przybliżeniu na 109,5º.
W fazie gazowej cząsteczka słabo oddziałuje z innymi siłami dyspersyjnymi. Również interakcje między podwójnymi wiązaniami (π-π) dwóch cząsteczek propylenu są powstrzymywane przez grupę metylową.
Powoduje to zmniejszenie ich sił międzycząsteczkowych, co znajduje odzwierciedlenie w ich właściwościach fizycznych. Tylko w bardzo niskich temperaturach propylen może przyjąć stałą strukturę, w której bumeran pozostaje zgrupowany ze swoimi słabymi oddziaływaniami.
Właściwości
Jest to bezbarwny gaz o aromatycznym zapachu. Jest transportowany w postaci skroplonego gazu, a kiedy ucieka z pojemników, które go zawierają, robi to w postaci gazu lub cieczy. Przy niskich stężeniach tworzy wybuchową i łatwopalną mieszaninę z powietrzem, gęstość propylenu jest wyższa niż powietrza.
Masa cząsteczkowa
42,081 g / mol
Temperatura wrzenia
53,9 ° F do 760 mmHg
48 ºC do 760 mmHg
Temperatura topnienia
301,4 ° F
185 ° C
Temperatura zapłonu
162 ° F
Rozpuszczalność
44,6 ml / 100 ml w wodzie.
1250 ml / 100 ml w etanolu.
524,5 ml / 100 ml w kwasie octowym.
Rozpuszczalność wyrażona jako masa
200 mg / l 25 ° C
Gęstość
0,609 mg / ml przy -52.6º F
0,5139 w 20 ° C
Gęstość pary
1,46 do 32 ° F (w odniesieniu do powietrza traktowanego jako punkt odniesienia).
1,49 (powietrze = 1).
1,91 kg / m3 do 273,15 ºK
Ciśnienie pary
1 mmHg przy -205,4ºF
760 mmHg do -53,9 ° F
8,69 x 103 mmHg w 25 ° C (wartość ekstrapolowana).
1158 kPa w 25 ° C
15,4 atm w 37 ° C
Samozapłon
851 ° F
455 ° C
Lepkość
83,4 mikropropy w 16,7 ° C.
Ciepło spalania
16 692 BTU / funt
10,940 cal / g
Ciepło parowania
104,62 cal / g (w temperaturze wrzenia)
Napięcie powierzchniowe
16,7 dyn / cm w 90 ° C
Polimeryzacja
Polimeryzuje w wysokich temperaturach i wysokich ciśnieniach w obecności katalizatorów.
Punkt zamarzania
185,25 ° C.
Próg zapachu
10-50 mg / m3 (wykrywanie)
100 mg / m3 (uznanie)
Używa

Jest on stosowany w przemyśle petrochemicznym jako paliwo i środek alkilujący. W przemyśle chemicznym stosowany jest jako surowiec do produkcji i syntezy wielu pochodnych.
Ma zastosowanie głównie w produkcji polipropylenu, akrylonitrylu (ACN), tlenku propylenu (PO), alkoholi, kumenu i kwasów akrylowych.
Polipropylen
Polipropylen jest jednym z głównych tworzyw sztucznych stosowanych w elektronice i akcesoriach elektrycznych, artykułach gospodarstwa domowego, kapslach i walizkach.
Laminowany materiał jest stosowany do pakowania słodyczy, etykiet, płyt CD itp., Podczas gdy włókna są wykonane z folderów i ubrań..
Akrylonitryl
Elastomeryczne polimery i włókna otrzymuje się z akrylonitrylu. Włókna te są przeznaczone do produkcji różnych form odzieży, takich jak swetry, skarpety i odzież sportowa. Stosowane są również w meblach domowych, w folderach, tapicerce, poduszkach i kocach.
Tlenek propylenu
Tlenek propylenu uczestniczy jako składnik w syntezie poliuretanu. Służy do produkcji elastycznej pianki i sztywnej pianki. Elastyczna pianka jest stosowana jako wypełniacz do mebli domowych i motoryzacyjnych.
Z drugiej strony sztywna pianka jest stosowana głównie jako materiał izolacyjny budynku.
Ponadto tlenek propylenu stosuje się do wytwarzania glikolu propylenowego. Związek ten jest stosowany do produkcji nienasyconych żywic poliestrowych i jako środek zapobiegający zamarzaniu.
Dodatkowo tlenek propylenu stosuje się do wytwarzania eteru glikolu propylenowego. Ten eter ma zastosowanie w produkcji farb, ubrań, farb, żywic i środków czyszczących.
Do syntezy alkoholi i innych zastosowań
Propylen umożliwia otrzymywanie niektórych alkoholi, w tym izopropanolu, stosowanego jako rozpuszczalnik w kosmetykach i produktach do pielęgnacji ciała. Ponadto spełnia funkcję środka antyseptycznego.
- Izopropanol jest zaangażowany w produkcję farb, żywic, farb drukarskich i taśm klejących. Jest również stosowany w przemyśle farmaceutycznym.
- Oksoalkohol 2-etyloheksanol jest stosowany w produkcji ftalanów, plastyfikatorów, materiałów klejących i farb.
- Butanol jest stosowany w produkcji farb, powłok, żywic, barwników, farmaceutyków i polimerów.
Z drugiej strony kumen jest wytwarzany z połączenia propylenu i benzenu. Kumen jest głównym związkiem w produkcji fenolu i acetonu, stosowanym w wielu produktach, takich jak poliwęglany, żywice fenolowe, żywice epoksydowe i metakrylan metylu..
Wreszcie, kwas akrylowy - inny produkt otrzymany z propylenu - jest wykorzystywany do produkcji estrów i żywic akrylowych do farb, powłok i klejów..
Referencje
- Michal Osmenda (26 grudnia 2007). Zapal mój ogień. [Rysunek] Pobrano 23 maja 2018 r. Z: commons.wikimedia.org
- Grupa Linde. (2018). Propylen Źródło: 23 maja 2018 r. Z: linde-gas.com
- Wikipedia. (2018). Propene Źródło: 23 maja 2018 r. Z: en.wikipedia.org
- PubChem. (2018). Propylen Źródło: 27 maja 2018 r. Z: pubchem.ncbi.nlm.nih.gov
- Vesovic Velisa. (7 lutego 2011 r.). Propylen Pobrane 27 maja 2018 r. Z: thermopedia.com
- Jeffrey S. Plotkin. (08 sierpnia 2016 r.). Dylemat propylenu. Źródło: 27 maja 2018 r. Z: acs.org
- ICIS. (6 listopada 2017). Zastosowania propylenu i dane rynkowe. Pobrano 27 maja 2018 r. Z: icis.com


