Charakterystyka i ograniczenia modelu atomowego Broglie
The Model atomowy Broglie został zaproponowany przez francuskiego fizyka Louisa Broglie w 1924 r. W swojej rozprawie doktorskiej Broglie potwierdził dualność falowo-cząstkową elektronów, kładąc fundamenty mechaniki fal. Broglie opublikował ważne teoretyczne odkrycia dotyczące natury falowo-korpusowej materii w skali atomowej.
Następnie stwierdzenia Broglie zostały eksperymentalnie wykazane przez naukowców Clintona Davissona i Lestera Germera w 1927 r. Teoria fal elektronowych Broglie'a opiera się na propozycji Einsteina dotyczącej właściwości falowych światła przy krótkich falach.
Broglie ogłosił możliwość, że materia ma zachowanie podobne do zachowania światła i zasugerował podobne właściwości w cząstkach subatomowych, takich jak elektrony.
Ładunki elektryczne i orbity ograniczają amplitudę, długość i częstotliwość fali opisywanej przez elektrony. Broglie wyjaśnił ruch elektronów wokół jądra atomowego.
Indeks
- 1 Charakterystyka modelu atomowego Broglie
- 2 Eksperyment Davissona i Germera
- 3 Ograniczenia
- 4 Przedmioty zainteresowania
- 5 referencji
Charakterystyka modelu atomowego Broglie
Aby rozwinąć swoją propozycję, Broglie zaczął od zasady, że elektrony mają podwójną naturę między falą a cząstką, podobnie jak światło.
W tym sensie Broglie dokonał porównania obu zjawisk i na podstawie równań opracowanych przez Einsteina do badania falowej natury światła, wskazał:
- Całkowita energia fotonu, a w konsekwencji energia całkowita elektronu, wynika z iloczynu częstotliwości fali i stałej deski (6.62606957 (29) × 10 -34 Jules x sekund), jak wyszczególniono w następującym wyrażeniu:
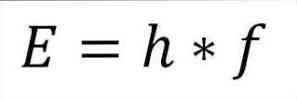
W tym wyrażeniu:
E = energia elektronów.
h = stała deska.
f = częstotliwość fali.
- Liniowy moment fotonu, a tym samym elektronu, jest odwrotnie proporcjonalny do długości fali, a obie wielkości są związane przez stałą Planka:
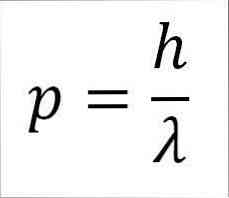
W tym wyrażeniu:
p = moment liniowy elektronu.
h = stała deska.
λ = długość fali.
- Liniowy pęd jest iloczynem masy cząstki o prędkości, jaką cząstka ma podczas swojego przemieszczenia.
Jeśli poprzednie wyrażenie matematyczne zostanie zrestrukturyzowane jako funkcja długości fali, mamy następujące:
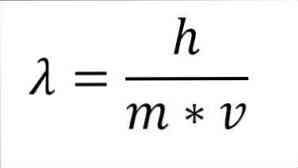
We wspomnianym wyrażeniu:
λ = długość fali.
h = stała deska.
m = masa elektronu.
v = prędkość elektronu.
Ponieważ h, stała Plank ma małą wartość, długość fali λ jest również. W konsekwencji możliwe jest stwierdzenie, że właściwości falowe elektronu występują tylko na poziomie atomowym i subatomowym.
- Broglie opiera się również na postulatach modelu atomowego Bohra. Według tego ostatniego orbity elektronów są ograniczone i mogą być tylko wielokrotnościami liczb całkowitych. Tak więc:
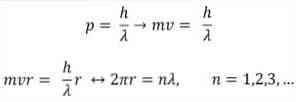
Gdzie:
λ = długość fali.
h = stała deska.
m = masa elektronu.
v = prędkość elektronu.
r = promień orbity.
n = liczba całkowita.
Zgodnie z modelem atomowym Bohra, który Broglie przyjął jako podstawę, jeśli elektrony zachowują się jak fale stojące, jedynymi dozwolonymi orbitami są te, których promień jest równy całkowitej wielokrotności długości fali λ.
Dlatego nie wszystkie orbity spełniają parametry niezbędne, aby elektron mógł się przez nie poruszać. Dlatego elektrony mogą podróżować tylko na określonych orbitach.
Teoria fal elektronów Broglie'a uzasadniała sukces modelu atomowego Bohra do wyjaśnienia zachowania pojedynczego elektronu atomu wodoru.
Analogicznie, rzuciło także światło na to, dlaczego ten model nie pasował do bardziej złożonych systemów, to znaczy atomów o więcej niż jednym elektronie.
Eksperyment Davissona i Germera
Eksperymentalna weryfikacja modelu atomowego Broglie miała miejsce 3 lata po jego opublikowaniu w 1927 roku.
Wybitni amerykańscy fizycy Clinton J. Davisson i Lester Germer potwierdzili eksperymentalnie teorię mechaniki fal.
Davisson i Germer przeprowadzili testy rozpraszania wiązki elektronów przez kryształ niklu i obserwowali zjawisko dyfrakcji przez ośrodek metalu.
Przeprowadzony eksperyment polegał na przeprowadzeniu następującej procedury:
- W pierwszej kolejności umieszczono zespół z wiązką elektronów o znanej energii początkowej.
- Zainstalowano źródło napięcia, aby przyspieszyć ruch elektronów, wywołując różnicę potencjałów.
- Przepływ wiązki elektronów skierowany był w kierunku kryształu metalicznego; w tym przypadku niklu.
- Zmierzono liczbę elektronów, które oddziaływały na kryształ niklu.
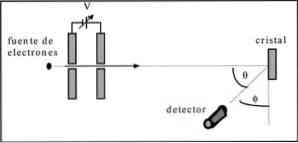
Pod koniec eksperymentu Davisson i Germer wykryli, że elektrony są rozproszone w różnych kierunkach.
Powtarzając eksperyment z użyciem kryształów metali o różnych orientacjach, naukowcy wykryli następujące:
- Rozrzut wiązki elektronów przez metaliczny kryształ był porównywalny ze zjawiskiem interferencji i dyfrakcji promieni świetlnych.
- Odbicie elektronów na krysztale uderzeniowym opisało trajektorię, która teoretycznie powinna opisywać zgodnie z teorią fal elektronowych Broglie.
Podsumowując, eksperyment Davissona i Germera wykazał eksperymentalnie podwójną elektronową naturę cząstek.
Ograniczenia
Model atomowy Broglie'a nie przewiduje dokładnej lokalizacji elektronu na orbicie, na której się porusza.
W tym modelu elektrony są postrzegane jako fale, które poruszają się po orbicie bez określonej lokalizacji, co wprowadza koncepcję elektronicznego orbitalu.
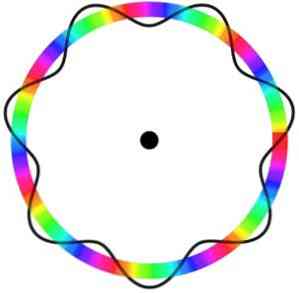
Ponadto model atomowy Broglie'a, analogiczny do modelu Schrödingera, nie uwzględnia obrotu elektronów na jego osi (wirować).
Ignorując wewnętrzny moment pędu elektronów, zaniedbuje się zmiany przestrzenne tych cząstek subatomowych..
W tej samej kolejności idei model ten nie uwzględnia zmian w zachowaniu szybkich elektronów w wyniku efektów relatywistycznych.
Interesy
Model atomowy Schrödingera.
Model atomowy Chadwicka.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Daltona.
Model atomowy Diraca Jordana.
Model atomowy Demokryta.
Model atomowy Bohra.
Referencje
- Teoria kwantowa Bohra i fale De Broglie (s.f.). Źródło: ne.phys.kyushu-u.ac.j
- Louis de Broglie - Biographical (1929). © Fundacja Nobla. Źródło: nobelprize.org
- Louis-Victor de Broglie (s.f.). Źródło: chemed.chem.purdue.edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Źródło: britannica.com
- Model atomowy De Broglie. National University of Distance Education. Hiszpania Źródło: ocw.innova.uned.es
- Fale materii Louisa De Broglie (s.f.). Źródło: hiru.eus
- Von Pamel, O. i Marchisio, S. (s.f.). Mechanika kwantowa Narodowy Uniwersytet Rosario. Źródło: fceia.unr.edu.ar


