Struktura etanu, właściwości, zastosowania i zagrożenia
The etan jest prostym węglowodorem o wzorze C2H6 o charakterze bezbarwnego i bezwonnego gazu, który ma bardzo cenne i zróżnicowane zastosowanie w syntezie etylenu. Ponadto jest to jeden z ziemskich gazów, który również został wykryty na innych planetach i ciałach gwiazd wokół Układu Słonecznego. Został odkryty przez naukowca Michaela Faradaya w 1834 roku.
Spośród dużej liczby związków organicznych utworzonych przez atomy węgla i wodoru (znane jako węglowodory), są takie, które są w stanie gazowym w temperaturach i ciśnieniach środowiskowych, które są wykorzystywane ogromnie w wielu gałęziach przemysłu.
Zwykle pochodzą one z mieszaniny gazowej zwanej „gazem ziemnym”, produktu o dużej wartości dla ludzkości i stanowią metan, etan, propan i butan typu metanu; sklasyfikowane według ilości atomów węgla w łańcuchu.
Indeks
- 1 Struktura chemiczna
- 1.1 Synteza etanu
- 2 Właściwości
- 2.1 Rozpuszczalność etanu
- 2.2 Krystalizacja etanu
- 2.3 Spalanie etanu
- 2.4 Etan w atmosferze i w ciałach niebieskich
- 3 zastosowania
- 3.1 Produkcja etylenu
- 3.2 Szkolenie podstawowych chemikaliów
- 3.3 Czynnik chłodniczy
- 4 Zagrożenia związane z etanem
- 5 referencji
Struktura chemiczna
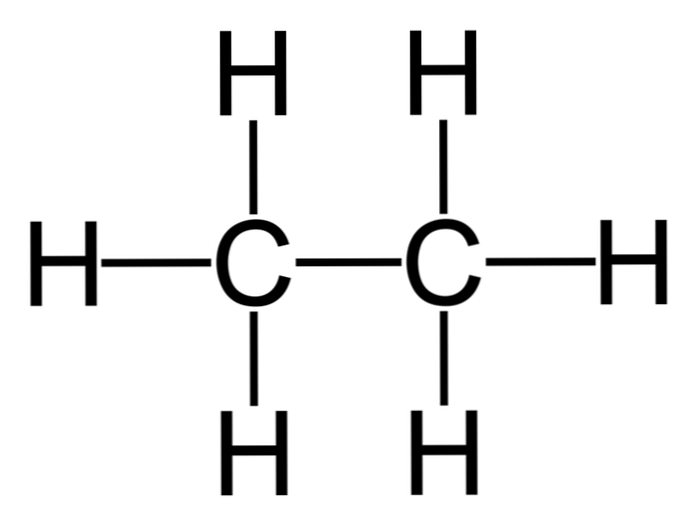
Etan jest cząsteczką o wzorze C2H6, zazwyczaj postrzegane jako połączenie dwóch grup metylowych (-CH3) aby utworzyć węglowodór prostego wiązania węgiel-węgiel. Jest to również najprostszy związek organiczny po metanie, przedstawiony w następujący sposób:
H3C-CH3
Atomy węgla w tej cząsteczce posiadają hybrydyzację sp3, więc wiązania molekularne wykazują swobodną rotację.
Istnieje również wewnętrzne zjawisko etanu, które opiera się na rotacji struktury molekularnej tego samego i minimalnej energii wymaganej do wytworzenia rotacji wiązania 360 stopni, którą naukowcy nazwali „barierą etanową”.
Z tego powodu etan może występować w różnych konfiguracjach w zależności od jego rotacji, nawet jeśli jego bardziej stabilna konformacja występuje tam, gdzie wodory są naprzeciw siebie (jak pokazano na rysunku).

Synteza etanu
Etan można łatwo syntetyzować z elektrolizy Kolbe, reakcji organicznej, w której zachodzą dwa etapy: elektrochemiczna dekarboksylacja (usunięcie grupy karboksylowej i uwalnianie dwutlenku węgla) dwóch kwasów karboksylowych oraz połączenie produktów związki pośrednie z wytworzeniem wiązania kowalencyjnego.
Podobnie elektroliza kwasu octowego prowadzi do powstawania etanu i dwutlenku węgla, i ta reakcja jest stosowana do syntezy pierwszego.
Utlenianie bezwodnika octowego przez działanie nadtlenków, koncepcja podobna do koncepcji elektrolizy Kolbego, powoduje również powstawanie etanu.
W ten sam sposób można go skutecznie oddzielić od gazu ziemnego i metanu w procesie skraplania, wykorzystując systemy kriogeniczne do wychwytywania tego gazu i oddzielania go od mieszanin z innymi gazami..
W tej roli preferowany jest proces turboekspansji: mieszanina gazów przechodzi przez turbinę, powodując jej ekspansję, aż jej temperatura spadnie poniżej -100 ° C.
Już w tym momencie składniki mieszaniny można różnicować, tak że ciekły etan zostanie oddzielony od gazowego metanu, a inne gatunki zaangażowane w destylację.
Właściwości
Etan występuje w naturze jako bezwonny i bezbarwny gaz przy standardowych ciśnieniach i temperaturach (1 atm i 25 ° C). Ma temperaturę wrzenia -88,5 ° C i temperaturę topnienia -182,8 ° C. Ponadto nie jest narażony na działanie silnych kwasów lub zasad.
Rozpuszczalność w etanolu
Cząsteczki etanu mają konfigurację symetryczną i mają słabe siły przyciągania, które utrzymują je razem, zwane siłami rozproszenia.
Gdy próbuje się rozpuścić etan w wodzie, siły przyciągania utworzone między gazem a cieczą są bardzo słabe, tak że bardzo trudno jest połączyć etan z cząsteczkami wody.
Z tego powodu rozpuszczalność etanu jest znacznie niska, zwiększając się nieznacznie, gdy wzrasta ciśnienie w układzie.
Krystalizacja etanu
Etan może zostać zestalony, co powoduje powstanie niestabilnych kryształów etanu o kubicznej strukturze krystalicznej.
Przy spadku temperatury powyżej -183,2 ° C struktura ta staje się jednoskośna, zwiększając stabilność jej cząsteczki.
Spalanie etanu
Ten węglowodór, nawet jeśli nie jest powszechnie stosowany jako paliwo, może być wykorzystywany w procesach spalania do wytwarzania dwutlenku węgla, wody i ciepła, co przedstawia się następująco:
2C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
Istnieje również możliwość spalenia tej cząsteczki bez nadmiaru tlenu, co jest znane jako „niepełne spalanie”, co powoduje powstawanie amorficznego węgla i tlenku węgla w niepożądanej reakcji, w zależności od ilości zastosowanego tlenu :
2C2H6 + 3O2 → 4C + 6H2O + Ciepło
2C2H6 + 4O2 → 2C + 2CO + 6H2O + Ciepło
2C2H6 + 5O2 → 4CO + 6H2O + Ciepło
W tym obszarze spalanie zachodzi poprzez szereg reakcji wolnych rodników, które są liczone w setkach różnych reakcji. Na przykład, związki takie jak formaldehyd, aldehyd octowy, metan, metanol i etanol mogą powstawać w reakcjach niepełnego spalania..
Będzie to zależało od warunków, w których zachodzi reakcja i zaangażowanych reakcji wolnych rodników. Etylen może być również wytwarzany w wysokich temperaturach (600-900 ° C), co jest produktem bardzo pożądanym przez przemysł.
Etan w atmosferze i ciałach niebieskich
Etan jest obecny w atmosferze Ziemi na śladach i podejrzewa się, że istota ludzka zdołała podwoić tę koncentrację, odkąd zaczął praktykować działalność przemysłową.
Naukowcy uważają, że obecna obecność etanu w atmosferze jest spowodowana spalaniem paliw kopalnych, chociaż globalna emisja etanu spadła o prawie połowę od czasu poprawy technologii produkcji gazu łupkowego ( źródło gazu ziemnego).
Gatunek ten jest również wytwarzany naturalnie dzięki działaniu promieni słonecznych na metan atmosferyczny, który rekombinuje i tworzy cząsteczkę etanu.
Etan istnieje w stanie ciekłym na powierzchni Tytana, jednego z księżyców Saturna. Występuje to w większej ilości w rzece Vid Flumina, która płynie przez ponad 400 kilometrów w kierunku jednego ze swoich mórz. Udowodniono to również na kometach i na powierzchni Plutona.
Używa
Produkcja etylenu
Zastosowanie etanu opiera się głównie na produkcji etylenu, najszerzej stosowanego produktu organicznego w światowej produkcji, w procesie znanym jako kraking parowy..
Proces ten polega na przepuszczeniu wsadu etanu rozcieńczonego parą do pieca, szybko go podgrzewając bez tlenu.
Reakcja zachodzi w skrajnie wysokiej temperaturze (między 850 a 900 ° C), ale czas przebywania (czas spędzony przez etan w piecu) musi być krótki, aby reakcja była skuteczna. W wyższych temperaturach powstaje więcej etylenu.
Szkolenie w zakresie podstawowych chemikaliów
Etan badano również jako główny składnik w tworzeniu podstawowych chemikaliów. Chlorowanie oksydacyjne jest jednym z procesów proponowanych do uzyskania chlorku winylu (składnika PVC), zastępując mniej kosztowne i bardziej skomplikowane.
Płyn chłodzący
Wreszcie, etan jest stosowany jako czynnik chłodniczy w typowych systemach kriogenicznych, pokazując również zdolność do zamrażania małych próbek w laboratorium do analizy.
Jest bardzo dobrym substytutem wody, która chłodzi delikatne próbki dłużej i może również tworzyć szkodliwe kryształy lodu.
Ryzyko związane z etanem
-Etan ma zdolność do zapalania się, zwłaszcza gdy wiąże się z powietrzem. W procentach od 3,0 do 12,5% objętości etanu w powietrzu może tworzyć się mieszanina wybuchowa.
-Może ograniczać tlen w powietrzu, w którym się znajduje, iz tego powodu stanowi czynnik ryzyka uduszenia dla ludzi i zwierząt, które są obecne i narażone.
-Etan w postaci zamrożonej cieczy może poważnie spalić skórę, jeśli wejdzie z nią w bezpośredni kontakt, a także działać jako medium kriogeniczne dla każdego dotkniętego obiektu, zamrażając ją w mgnieniu oka.
-Opary ciekłego etanu są cięższe od powietrza i koncentrują się na ziemi, co może stwarzać ryzyko zapłonu, który może spowodować reakcję spalania łańcucha.
-Spożycie etanu może powodować nudności, wymioty i krwawienie wewnętrzne. Wdychanie, oprócz uduszenia, powoduje bóle głowy, dezorientację i wahania nastroju. Śmierć z powodu zatrzymania akcji serca jest możliwa przy dużych narażeniach.
-Stanowi on gaz cieplarniany, który wraz z metanem i dwutlenkiem węgla przyczynia się do globalnego ocieplenia i zmian klimatycznych generowanych przez zanieczyszczenia ludzkie. Na szczęście jest mniej obfity i trwały niż metan i pochłania mniej promieniowania niż to.
Referencje
- Britannica, E. (s.f.). Etan. Źródło: britannica.com
- Nes, G. V. (s.f.). Struktury jednokrystaliczne i rozkłady gęstości elektronowej etanu, etylenu i acetylenu. Odzyskany z rug.nl
- Witryny, G. (s.f.). Ethane: Źródła i umywalki. Pobrane z sites.google.com
- SoftSchools. (s.f.). Formuła etanowa. Odzyskane z softschools.com
- Wikipedia. (s.f.). Etan. Źródło z en.wikipedia.org


