Historia kalorymetru, części, typy i ich charakterystyka
The kalorymetr jest urządzeniem służącym do pomiaru zmiany temperatury pewnej ilości substancji (zwykle wody) o znanym cieple właściwym. Ta zmiana temperatury jest spowodowana ciepłem absorbowanym lub uwalnianym w badanym procesie; chemiczny, jeśli jest to reakcja, lub fizyczny, jeśli składa się ze zmiany fazy lub stanu.
W laboratorium najprostszym kalorymetrem, jaki można znaleźć, jest kalorymetr. Służy do pomiaru ciepła absorbowanego lub uwalnianego w reakcji pod stałym ciśnieniem w roztworze wodnym. Reakcje dobiera się tak, aby uniknąć interwencji odczynników lub produktów gazowych.
 W reakcji egzotermicznej ilość wydzielanego ciepła można obliczyć na podstawie wzrostu temperatury kalorymetru i roztworu wodnego:
W reakcji egzotermicznej ilość wydzielanego ciepła można obliczyć na podstawie wzrostu temperatury kalorymetru i roztworu wodnego:
Ilość ciepła uwalnianego w reakcji = ilość ciepła zaabsorbowanego przez kalorymetr + ilość ciepła zaabsorbowanego przez roztwór
Ilość ciepła pochłanianego przez kalorymetr nazywa się kalorymetrem. Jest to określone przez dostarczenie znanej ilości ciepła do kalorymetru przy danej masie wody. Następnie mierzony jest wzrost temperatury kalorymetru i roztworu, który zawiera.
Dzięki tym danym i wykorzystaniu ciepła właściwego wody (4,18 J / g ° C) można obliczyć pojemność kalorymetryczną kalorymetru. Ta pojemność jest również nazywana stałą kalorymetru.
Z drugiej strony ciepło uzyskane przez roztwór wodny jest równe m · ce · Δt. We wzorze m = masa wody, ce = ciepło właściwe wody i Δt = zmiana temperatury. Wiedząc to wszystko, można obliczyć ilość ciepła uwolnionego przez reakcję egzotermiczną.
Indeks
- 1 Historia kalorymetru
- 2 części
- 3 Typy i ich cechy
- 3.1 Filiżanka kawy
- 3.2 Pompa kalorymetryczna
- 3.3 Kalorymetr adiabatyczny
- 3.4 Kalorymetr izoperiboliczny
- 3.5 Kalorymetr przepływowy
- 3.6 Kalorymetr do różnicowej kalorymetrii skaningowej
- 4 Aplikacje
- 4.1 W fizykochemii
- 4.2 W systemach biologicznych
- 4.3 Kalorymetr pompy tlenu i mocy kalorycznej
- 5 referencji
Historia kalorymetru
W 1780 roku A. L. Lavoisier, francuski chemik, uważany za jednego z ojców chemii, użył świnki morskiej do pomiaru produkcji ciepła przez jego oddech.
Jak? Używanie urządzenia podobnego do kalorymetru. Ciepło wytwarzane przez świnkę morską zostało udowodnione przez topnienie śniegu otaczającego aparat.
Naukowcy A. L Lavoisier (1743-1794) i P. S. Laplace (1749-1827) zaprojektowali kalorymetr, który był używany do pomiaru ciepła właściwego ciała metodą topienia lodu.
Kalorymetr składał się z cynowanej, cylindrycznej zlewki, lakierowanej, trzymanej na statywie i zakończonej wewnętrznie lejkiem. Wewnątrz umieszczono kolejną szklankę, podobną do poprzedniej, z rurką przechodzącą przez zewnętrzną komorę i zaopatrzoną w klucz. Wewnątrz drugiej szyby była siatka.
W tej siatce umieszczono istotę lub obiekt, którego ciepło właściwe było określone. Lód został umieszczony wewnątrz koncentrycznych naczyń, tak jak w koszu.
Ciepło wytwarzane przez ciało zostało wchłonięte przez lód, powodując jego stopienie. A ciekły produkt wodny topnienia lodu został zebrany, otwierając klucz wewnętrznego szkła.
I wreszcie, ważąc wodę, znana była masa stopionego lodu.
Części
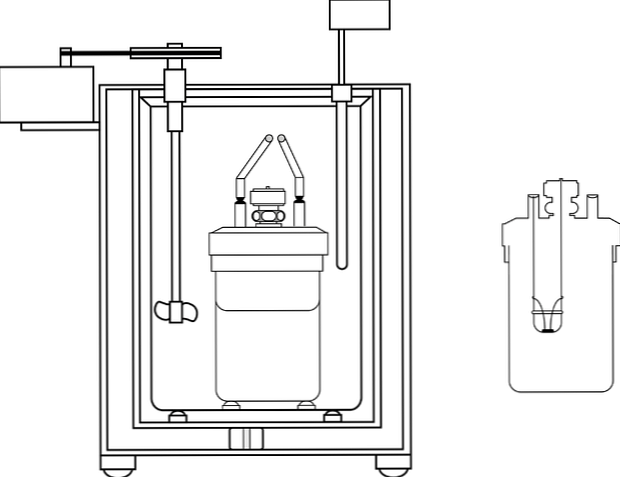
Najczęściej stosowanym kalorymetrem w laboratoriach nauczania chemii jest tak zwany kalorymetr do filiżanek kawy. Ten kalorymetr składa się ze zlewki lub zamiast tego pojemnika z anime, który ma pewne właściwości izolacyjne. Wewnątrz tego pojemnika roztwór wodny jest umieszczany z ciałem, które wytwarza lub absorbuje ciepło.
W górnej części pojemnika znajduje się pokrywa z materiału izolacyjnego z dwoma otworami. W jednym z nich wprowadza się termometr do pomiaru zmian temperatury, a w drugim mieszadło, korzystnie z materiału szklanego, które wykonuje funkcję przemieszczania zawartości roztworu wodnego.
Obraz pokazuje części pompy kalorymetrycznej; można jednak zauważyć, że ma termometr i mieszadło, wspólne elementy w kilku kalorymetrach.
Typy i ich cechy
Filiżanka kawy
Jest to taki, który jest używany do określania ciepła uwalnianego przez reakcję egzotermiczną i ciepło absorbowane w reakcji endotermicznej.
Ponadto może być stosowany do określania ciepła właściwego ciała; to znaczy ilość ciepła, którą gram substancji musi wchłonąć, aby podnieść temperaturę o jeden stopień Celsjusza. .
Pompa kalorymetryczna
Jest to urządzenie, w którym mierzy się ilość ciepła uwalnianego lub absorbowanego w reakcji zachodzącej przy stałej objętości.
Reakcja zachodzi w silnym stalowym naczyniu (pompie), który jest zanurzony w dużej objętości wody. Dzięki temu zmiany temperatury wody są niewielkie. Dlatego zakłada się, że zmiany związane z reakcją są mierzone przy stałej temperaturze i objętości.
Powyższe wskazuje, że żadna praca nie jest wykonywana, gdy reakcja jest przeprowadzana w pompie kalorymetrycznej.
Reakcja rozpoczyna się od dostarczenia energii elektrycznej przez kable podłączone do pompy.
Kalorymetr adiabatyczny
Charakteryzuje się strukturą izolacyjną zwaną tarczą. Osłona znajduje się wokół komórki, w której zachodzą zmiany temperatury i temperatury. Jest również połączony z systemem elektronicznym, który utrzymuje temperaturę bardzo zbliżoną do temperatury ogniwa, aby uniknąć przenoszenia ciepła.
W kalorymetrze adiabatycznym różnica temperatur między kalorymetrem a jego otoczeniem jest zminimalizowana; jak również minimalizując współczynnik przenikania ciepła i czas wymiany ciepła.
Jego części składają się z następujących elementów:
-Komórka (lub pojemnik) zintegrowana z systemem izolacji, dzięki której próbuje się uniknąć strat ciepła.
-Termometr do pomiaru zmian temperatury.
-Grzejnik podłączony do sterowanego źródła napięcia elektrycznego.
-I wspomniana już tarcza.
W tego typu kalorymetrze można określić właściwości takie jak entropia, temperatura Debye'a i gęstość stanu elektronicznego.
Kalorymetr izoperiboliczny
Jest to urządzenie, w którym ogniwo reakcyjne i pompa są zanurzone w strukturze zwanej płaszczem. W tym przypadku tak zwana kurtka składa się z wody, utrzymywanej w stałej temperaturze.
Temperatura ogniwa i pompy wzrasta wraz z uwalnianiem ciepła podczas procesu spalania; ale temperatura płaszcza wodnego jest utrzymywana na stałym poziomie.
Mikroprocesor kontroluje temperaturę ogniwa i płaszcza, dokonując niezbędnych korekt ciepła wycieku, które wynika z różnic między dwiema temperaturami.
Korekty te są stosowane w sposób ciągły, z poprawką końcową, w oparciu o pomiary przed i po teście.
Kalorymetr przepływowy
Opracowany przez Caliendar, ma urządzenie do przemieszczania gazu w pojemniku ze stałą prędkością. Podczas dodawania ciepła mierzy się wzrost temperatury płynu.
Kalorymetr przepływowy charakteryzuje się:
- Dokładny pomiar stałego natężenia przepływu.
- Dokładny pomiar ilości ciepła wprowadzanego do płynu przez grzejnik.
- Dokładny pomiar wzrostu temperatury gazu spowodowany poborem energii
- Konstrukcja do pomiaru pojemności gazu pod ciśnieniem.
Kalorymetr do różnicowej kalorymetrii skaningowej
Charakteryzuje się posiadaniem dwóch pojemników: w jednym umieszcza się próbkę, która ma być badana, podczas gdy druga jest pusta lub używany jest materiał odniesienia.
Oba naczynia są ogrzewane ze stałą prędkością energetyczną za pomocą dwóch niezależnych grzejników. Gdy rozpocznie się ogrzewanie dwóch pojemników, komputer wykreśli różnicę przepływu ciepła przez grzejniki w stosunku do temperatury, dzięki czemu będzie mógł określić przepływ ciepła.
Ponadto można określić zmianę temperatury w funkcji czasu; i wreszcie pojemność kaloryczna.
Aplikacje
W fizykochemii
-Podstawowe kalorymetry, typ filiżanki kawy, pozwalają zmierzyć ilość ciepła, którą ciało uwalnia lub pochłania. Mogą określić, czy reakcja jest egzotermiczna czy endotermiczna. Ponadto można określić ciepło właściwe ciała.
-Za pomocą kalorymetru adiabatycznego możliwe było określenie entropii procesu chemicznego i gęstości elektronicznej stanu.
W systemach biologicznych
-Mikrokalorymetry są używane do badania układów biologicznych, które obejmują interakcje między cząsteczkami, jak również zmiany konformacji molekularnej, które występują; na przykład w rozwijaniu cząsteczki. Linia obejmuje zarówno skanowanie różnicowe, jak i miareczkowanie izotermiczne.
-Mikrokalorymetr jest wykorzystywany w opracowywaniu leków o małych cząsteczkach, bioterapeutyków i szczepionek.
Kalorymetr pompy tlenowej i moc kaloryczna
Spalanie wielu substancji zachodzi w kalorymetrze z pompą tlenową i można określić jego moc kaloryczną. Wśród substancji badanych za pomocą tego kalorymetru są: węgiel i koks; oleje jadalne, zarówno ciężkie, jak i lekkie; benzyna i wszystkie paliwa silnikowe.
Jak również rodzaje paliw do reaktorów lotniczych; odpady paliwowe i usuwanie odpadów; produkty spożywcze i suplementy do żywienia ludzi; rośliny pastewne i dodatki do pasz dla zwierząt; materiały budowlane; paliwa rakietowe i paliwowe.
Podobnie moc kaloryczna została określona za pomocą kalorymetrii w badaniach termodynamicznych materiałów palnych; w badaniu równowagi energetycznej w ekologii; w materiałach wybuchowych i proszkach cieplnych oraz w nauczaniu podstawowych metod termodynamicznych.
Referencje
- Whitten, Davis, Peck & Stanley. Chemia (8 wyd.). CENGAGE Learning.
- González J., Cortés L. & Sánchez A. (s.f.). Kalorymetria adiabatyczna i jej zastosowania. Odzyskany z: cenam.mx
- Wikipedia. (2018). Kalorymetr. Źródło: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 czerwca 2018 r.). Definicja kalorymetru w chemii. Źródło: thinkco.com
- Gillespie, Claire. (11 kwietnia 2018). Jak działa kalorymetr? Nauka. Źródło: sciencing.com


